| |
RESUMEN
El proceso Anammox es la
forma de metabolismo más prometedora
para denitrificación en efluentes
residuales, y quizás el ejemplo más
claro en el cual su potencial uso en ingeniería
depende del conocimiento detallado de los
microorganismos en el proceso. Este proceso
es poco conocido en Latinoamérica,
aun cuando existe una gran difusión
en el mundo científico. Se presenta
una revisión general del proceso
Anammox, la intervención de su actividad
bacteriana en los procesos de transformación
de los compuestos nitrogenados y en el ciclo
del Nitrógeno, igualmente la biología
de las bacterias reportadas que intervienen
en este proceso y la bioquímica del
mismo. También se describen algunas
técnicas de identificación
como Hibridación In Situ con Fluorescencia
FISH y Reacción en Cadena de la Polimerasa
PCR, para los grupos bacterianos y potenciales
aplicaciones en los sistemas de tratamiento
terciarios para aguas residuales domésticas
con altas concentraciones de amonio y nitratos.
PALABRAS CLAVE
Anammox, anamoxisoma, remoción de
compuestos nitrogenados, aguas residuales
domésticas.
ABSTRACT
The anammox process is the most promissory
metabolism for denitrification of waste
water, and clear example in which his potential
uses in Engineering solution, depend on
advanced knowledge of microorganisms involved
in the process. Despite of important number
of publication, anammox process is poverty
known in Latin-American countries. In this
article is shown a general coments of the
process Anammox, its intervention in the
cycle of nitrogen, within the context of
the bacterial activity in the transformation
of nitrogen compounds. The Biology of the
reported bacteria that are involved in this
process and their biochemistry will be described.
Some techniques, as Fluorescent in situ
hybridization -FISH, and Polymerase Chain
Reaction PCR, actually applied for identification
of the bacterial groups and their potential
applications in tertiary wastewater treatment
systems, with high ammonium and nitrates
concentrations.
KEYWORDS
Anammox, anammoxosome, nitrogen compounds
removal, advance treatment systems, domestic
wastewater.
1. INTRODUCCIÓN
Las aguas residuales (domésticas,
y algunas de tipo industrial) sin tratar
o efluentes parcialmente tratados, son fuente
de grandes cantidades de nutrientes en forma
de compuestos nitrogenados y fosfatos que
comúnmente se descargan a los cuerpos
de agua naturales. El exceso de nitrógeno
añadido en los cuerpos de agua por
esta vía puede provocar el fenómeno
conocido como eutroficación, responsable
de la mortandad de peces, aumento de la
frecuencia del florecimiento de algas dañinas,
cambios en las especies dentro de los ecosistemas
de la costa y acidificación global
de sistemas acuáticos y terrestres
(Ahn, 2006) y, por supuesto, disminución
en la oferta de calidad de agua para potabilizar.
Según el documento Conpes 3383 del
Departamento Nacional de Planeación
de Colombia, sólo se trata el 10%
de las aguas residuales que se producen
en el país antes de ser vertidas
a los cuerpos de aguas naturales o reutilizadas.
En países industrializados se han
venido realizando investigaciones para la
eliminación del amonio presente en
aguas residuales mediante bacterias Anammox,
microorganismos capaces de oxidar el amonio
en condiciones anaerobias con producción
de N2. Con este tipo de tecnologías
se eliminan los intermediarios de óxidos
nitrosos que contribuyen al efecto invernadero
(Cervantes-Carillo, 2000; Inamori, 2007)
se disminuyen los costos de aireación
y adición de compuestos orgánicos
como el metanol, usados en los procesos
convencionales de denitrificación.
Las investigaciones existentes
en la región describen la eficiencia
de eliminación de compuestos nitrogenados
como porcentajes de eliminación.
En sistemas ubicados en países con
estaciones se ha hecho mas énfasis
en el estudio microbiológico (Noophan,
2009; Qiao, 2009; Sánchez-Melsió,
2009; Xiao, 2009). Sin embargo, se desconoce
si ocurre lo mismo con el componente microbiológico
y su relación con la eficiencia de
los tratamientos en las condiciones de diversidad
de trópico en presencia del tipo
de contaminantes y en las condiciones climáticas
propias de la zona. Hoy se reconoce que
el conocimiento y evaluación de la
diversidad de los microorganismos en los
sistemas de tratamiento biológico
y el entendimiento de la interacción
metabólica que existe entre ellos
son herramientas para mejorar el rendimiento
en los procesos e implementar sistemas biotecnológicos
innovadores de tratamiento de aguas residuales
o componentes específicos en ellos.
2. REVISIÓN
DE LITERATURA
El ciclo global
del nitrógeno
Definido como la serie
continua de procesos naturales en los cuales
el nitrógeno se transforma a distintos
estados de oxidación y reducción:
de Nitrógeno Molecular (N2) a Amoniaco
(NH3), luego a compuestos orgánicos
carbono-nitrogenados, óxidos de nitrógeno
y finalmente a N2 mediante denitrificación
y oxidación anaerobia, cerrando el
ciclo (Warakomski, 2007). El ciclo del nitrógeno
se constituye como componente mayoritario
de proteínas, ácidos nucleicos
y otros constituyentes celulares; la mayor
parte del nitrógeno utilizable está
en forma inorgánica, bien sea como
amoniaco o nitrato. Sin embargo, acciones
antropogénicas, como la producción
industrial de NH4+ y NO3- como fertilizantes
para sostener el incremento acelerado de
la población humana (Gruber, 2008),
la combustión de hidrocarburos fósiles
y la descarga de aguas residuales, entre
otras, han acelerado y desbalanceado considerablemente
el ciclo del nitrógeno, con efectos
negativos, tales como la eutrofización
de los cuerpos de agua receptores, el efecto
invernadero por la generación de
Óxido Nitroso (N2O) y los riesgos
para la salud humana como el consumo de
nitratos (NO3-) en el agua potable (Towsend,
2003). Las formas del nitrógeno pueden
ser “no reactivas” como el N2
o “reactivas” (Nr) como se encuentra
en todas sus otras formas (Galloway, 2008).
El mayor reservorio de N2 se encuentra en
la atmósfera (78 % de la misma) y
debe ser fijado a una forma reactiva para
su aprovechamiento en la biosfera (Francis,
2007). Otras formas de N presentes en la
atmósfera son las pequeñas
cantidades de óxidos de nitrógeno,
NH3 gaseoso, compuestos de NH4+, ácido
nítrico (HNO3), partículas
de NO3- y N orgánico, que circulan
a través de ella (Nieder, 2008).
Entre las transformaciones a gran escala
se destacan: la fijación biológica,
lumínica e industrial, la combustión
de hidrocarburos fósiles y los procesos
biológicos de oxido-reducción.
La fijación industrial para la producción
de fertilizantes nitrogenados (100 Tg año-1
de 355 totales fijados globalmente, 250
por microorganismos y 5 por tormentas).
Detalles de los procesos de la actividad
microbiana en la transformación del
nitrógeno incluyendo los conocimientos
más recientes han sido publicados
recientemente (Sánchez, 2009).
Intervención
del proceso Anammox en el ciclo del nitrógeno
Reportes iniciales de la
actividad de los Anammox en el mar demuestran
que son responsables del 67% de la producción
de N2 a 700 m de profundidad, 24% a 380
m y 2% a 16 m (Dalsgaard, 2005). La contribución
del proceso Anammox a nivel del ciclo global
del N se calcula entre el 30% y el 50% de
la producción total de N2,, específicamente
en los sedimentos marinos (Hamersley, 2007)
Oxidación
anaerobia del NH4¯ (Anammox)
Annamox (Ananerobic Ammonium
Oxidation) es un proceso que consiste en
la reducción del NO2- acoplada a
la oxidación del NH4+ (Schmid, 2005)
para formar N2. Hasta 1995, el proceso de
nitrificación conocido estaba relacionado
con el consumo de oxígeno; es decir,
el NH4+ se consideraba relativamente estable
en condiciones anóxicas, pero algunos
investigadores describieron por primera
vez la oxidación del NH4+ en condiciones
anaerobias, considerando el NH4+ como donador
de electrones y el NO3- como aceptor final;
a este proceso se le denominó Anammox
(Graff, 1995; Mulder, 1995); posteriormente
otros investigadores coincidieron en que
la clave para la oxidación del NH4+
era el NO2- como aceptor de electrones y
no el NO3 (Jin, 2008). Sin embargo, actualmente
pruebas con isótopo 15 y otros experimentos
reportan la posibilidad de que el aceptor
de electrones puede ser tanto el NO3- como
el NO2- (Kartal, 2007). El NH4+ podría
ser oxidado por dos vías: la primera
hipótesis es que el NH4+ es oxidado
hasta Hidroxilamina, la cual a su vez es
oxidada a nitrito por la enzima Hidroxilamina
Oxidoreductasa (HAO) que contiene 24 citocromos
c, involucrados en el proceso de transferencia
de electrones (Kuenen, 2008); posteriormente
el NH4+ y el NO2- son convertidos a N2 (Ye,
2001). La segunda hipótesis plantea
que el NO2- es reducido por la nitrito oxidoreductasa
a hidroxilamina y que de alguna manera esta
última reacciona con el NH4+, conduce
a la producción de N2, con Hidracina
como intermediario de este último
paso (Jetten, 2001) por medio de la hidracina
oxidasa o la HAO, la hidroxilamina actúa
como aceptor de electrones oxidando hidracina
a N2 (Chamchoi, 2007). La hidracina, usada
como combustible de cohetes, es altamente
tóxica y hasta el momento no había
sido reportado su presencia en otros microorganismos
(Pilcher, 2005). Finalmente, en presencia
de NH4+ y NO2- en proporciones similares,
las comunidades Anammox actúan eficientemente
en la producción de N2 (Strous, 1997).
El nitrito, que actúa como aceptor
de electrones, no está disponible
bajo condiciones anóxicas, razón
por la cual la oxidación anaerobia
de amonio depende de su transporte desde
capas óxicas (Schmidt, 2002).
Basada en el balance de masa de comunidades
enriquecidas de bacterias Anammox, la estequiometría
de la segunda reacción es presentada
de la siguiente manera:
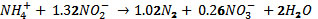
(van. Dongen, 2001; Goven,
2005). Algunos estudios demuestran que el
radio estequiométrico de consumo
de NH4+, consumo de NO2- y producción
de NO3- es de 1:1.2:0.33 (Tsushima, 2007).
Otras formas de denitrificación autótrofa
incluyen la relacionada con algunos microorganismos
quimioautótrofos oxidadores del azufre,
como son los thiobacillus denitrificans,
los cuales son anaerobios facultativos y
utilizan el NO3- como aceptor final de electrones:
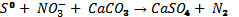
(Maier, 2000).
Biología
de bacterias Anammox
Las bacterias ANAMMOX,
denominadas así por el tipo de metabolismo
que realizan oxidación anaerobia
de amonio (anaerobic ammonium), fueron descubiertas
en lodos de aguas residuales a principios
de los años 90 (Mulder et al., 1995).
Sin embargo, la discusión de la posibilidad
de que ocurriese esta reacción se
venía dando desde 1977 por algunos
investigadores y 10 años después
en una compañía de fermentación
en Holanda se observó que el amonio
desapareció con un claro incremento
del N2 (Jetten, 2004). Éstas corresponden
a microorganismos quimiolitoautótrofos
que oxidan el NH4- con nitrito o nitrato
como aceptor de electrones, obteniendo energía
para la fijación de CO2 y produciendo
N2; poseen una versatilidad metabólica
con capacidad de oxidar cadenas de ácidos
grasos en presencia de NO2- o NO3-, , actuando
en la reducción desasimilatoria de
NO3- a NH4- (RDNA), versatilidad que tiene
importantes aplicaciones ecológicas
y bioquímicas, ya que extienden su
espectro ambiental (Galán, 2009).
Estudios adicionales demuestran que las
bacterias Anammox pueden usar algunos compuestos
orgánicos como fuente de carbono,
aunque las mismas han sido descritas como
quimiolitoautótrofas obligadas; también
se ha observado que pueden ser inhibidas
por algunos compuestos orgánicos
como el metanol (Guven, 2005).
Taxonomía
de bacterias Anammox
Las bacterias Anammox,
pertenecen al dominio Bacteria, Phylum Plantomicetes,
clase Plantomicetia, orden Planctomycetales
(descubiertas en 1986 por Schlessner y Stackebrandt)
y a la familia Plantomicetacea, donde se
incluyen 4 géneros, Planctomyces,
Pirellula, Gemmata e Isosphaera. (Schmidt
, 2002). El proceso ANAMMOX es realizado
por un grupo de microorganismos, Planctomyces,
de los cuales 5 subgéneros han sido
reportados y nombrados provisionalmente
(Chamchoi, 2007), Brocadia (anamoxidans
y fulgida), Kuenenia (stuttgartiensis),
Scalindua (Wagneri, Brodae, sorokini), Anammoxoglobus
(propionicus) y Jettenia (asiatica )
(Yang, 2007).
Estructura celular
de bacterias Anammox
La secuencia genómica
del planctomycete Pirelulla es característica
de una bacteria, aunque el 8% y el 9% se
asemejan a Eucariotas y Arqueas, respectivamente
(Jetten, 2004). Las bacterias Anammox son
coloides, de menos de un micrómetro
de diámetro y no pueden ser cultivadas
en el laboratorio por técnicas convencionales
(Chamchoi, 2007). Poseen compartimientos
sub-celulares (organelas) de doble membrana,
que los hacen similares a los Eucariotas
y la ausencia de un polímero de peptidoglicano
en su pared celular que los asemeja a las
Arqueas (Pilcher, 2005). Las funciones de
estas organelas están bajo estudio
y se considera que en ellas se desarrolla
la oxidación anaerobia de amonio,
ésta es llamada anamoxisoma (Kuenen,
2008) y corresponde a más del 30%
del volumen celular (Jetten, 2004); entre
otras funciones atribuidas a este compartimiento,
se encuentran la división celular
y replicación cromosómica.
Las bacterias ANAMMOX expresan en la membrana
del anamoxisoma lípidos ladderane,
descritos como lípidos inusuales
de baja energía y muy inestables,
además de lípidos hopanoides
(Jetten, 2004).
La densidad e impermeabilidad
de los lípidos evitan que los compuestos
tóxicos intermediarios de la reacción,
como la N24, se dirijan al espacio extracelular
(Pilcher, 2005) y afecten las demás
funciones celulares (Innerebner, 2007).
Los lípidos ladderane tienen de 3
a 5 enlaces lineales concatenados de ciclobutano,
tanto éster como éter (Schmid,
2003).
Otras organelas de los
planctomycetes son: el pirelulosoma que
contiene un nucleoide, el riboplasma que
contiene los ribosomas (Schmid, 2003) y
el perifoplasma sólo en las ANAMMOX;
es periférico y contiene el citoplasma
separado de los demás compartimientos
al interior de la célula por una
membrana intracitoplasmática (Mike,
2001) (ver Figura 1).
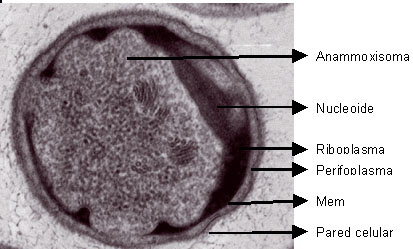
Figura 1 Microfotografía
electrónica de Estructura celular
(Kuenen, 2008)
3. MÉTODOS DE IDENTIFICACIÓN
Usando sondas de oligonucleótidos
de RNA ribosomal subunidad 16S para la aplicación
en la técnica Hibridación
In Situ con Fluorescencia (FISH), se han
detectado bacterias ANAMMOX en diferentes
hábitats, tales como, plantas de
tratamiento de aguas residuales, sedimentos
de aguas frescas y ecosistemas marinos (Kuenen,
2008) como zonas subóxicas del Mar
Negro (género Scalindua) (Reginatto,
2005). Se encuentran generalmente en forma
de biopelículas o flóculos
en diversos ecosistemas acuáticos,
con condiciones limitantes de oxígeno
o interfase oxico/anóxico (Cirpus,
2006).
FISH es una técnica
molecular que ha sido ampliamente usada
en la cuantificación y descripción
de células microbianas presentes
en lodos activados y aguas residuales (Daims,
2007; Gilbride, 2006; Hung, 2005; Moter,
2000). En esta técnica, los microorganismos
son tratados con un fijador
e hibridados con sondas
específicas marcadas con colorantes
fluorescentes en una lámina portaobjetos.
Posteriormente las láminas son observadas
en un microscopio de fluorescencia (Göbel,
2000).Según las más recientes
investigaciones realizadas al ciclo del
nitrógeno en aguas residuales, las
sondas más usadas para su análisis
por el método de FISH son: NSO 1225,
género Nitrosomonas, NIT3, género
Nitrobacter, 820 Bacterias ANAMMOX y PLA
46, Orden Planctomycetales (Chamchoi, 2007;
Ismail, 2007; Kindaichi, 2007).
Otra técnica molecular
ampliamente usada en la microbiología
ambiental para la detección de microorganismos
en muestras ambientales es la PCR Reacción
en cadena de la Polimerasa,
la cual consiste en la amplificación
selectiva de fragmentos cortos de DNA y
se fundamenta en la propiedad de las enzimas
DNA polimerasas para replicar hebras de
DNA. Se realiza en varios ciclos alternando
la temperatura para separar las hebras de
DNA, alinear los primers o cebadores y replicar
el DNA por medio de la enzima. La extracción
de DNA de las muestras es un paso crucial,
ya que de la calidad del DNA depende en
gran medida el resultado de PCR. Generalmente
se amplifican los fragmentos de genes que
producen rRNA 16s, por ser una de las regiones
más conservadas genéticamente,
o fragmentos de genes de enzimas específicas.
El DNA amplificado o producto
PCR debe ser analizado para crear o interpretar
la huella genética, normalmente se
utiliza la “electroforesis”.
En esta técnica el DNA se separa
en zonas según su tamaño molecular
gracias a la acción de campos eléctricos
(Rittmann, 2001). Algunos métodos
complementarios o también llamados
métodos basados en PCR de uso frecuente
son la Electroforesis en Gel con Gradiente
Desnaturalizante (DGGE) y la Restricción
de Polimorfismo de Longitud de Fragmento
(RFLP) (Sáenz, 2007). En algunos
estudios donde se evalúan bacterias
Anammox se han usado el primer Pla46f, en
combinación con el primer 1378r,
1404r, o 907r (Innerebner, 2007) y el par
amoA-1F y amoA-2R entre otros (Wang, 2009).
Generalmente, los productos de PCR son separados
en un gel de agarosa al 0,8% y visualizados
con bromuro de etidio (Egli, 2003). Un ejemplo
de aplicación de PCR en tiempo real
fue usado en plantas de tratamiento para
cuantificar la población de bacterias
Anammox en un reactor de disco rotatorio
(McMahon, 2008). La mezcla de dos o varias
técnicas moleculares resulta muy
útil para el estudio de las poblaciones
microbianas presentes en los sistemas de
tratamiento y su comportamiento en tiempo
y en espacio, tales como DGGE, RFLP, secuenciación,
Clonación, Citometría de flujo
y FISH (Innerebner, 2007; McMahon, 2008)
3.1. Aplicaciones
potenciales del metabolismo Anammox en remoción
de nitrógeno dentro de sistemas de
tratamiento de agua residual
A partir de 1995 se inició
el estudio y enriquecimiento de las poblaciones
bacterianas responsables de ese proceso,
dada su potencial aplicabilidad en el tratamiento
de aguas residuales (Mulder et al., 1995).
Posteriormente se observó claramente
que la clave para la oxidación del
amonio era el nitrito como aceptor de electrones
en cambio del nitrato y se experimentaron
distintas configuraciones de reactores como
biofiltros de corteza fija y fluidizada
y se trataron los efluentes de la digestión
de lodos, ricos en amonio, demostrando la
aplicabilidad del proceso en la remoción
de amonio y nitrito, muy eficiente cuando
estos dos compuestos están en concentraciones
parecidas (Strous, 1997). Los microorganismos
que intervienen en el proceso son autótrofos,
por lo que no requieren fuente de carbono;
pero como se mencionó anteriormente
requiere de una fuente de nitrito como aceptor
de electrones para la remoción de
amonio. Varios diseños incluyeron
un paso previo de nitrificación parcial
impidiendo la producción de nitratos;
es decir, la oxidación de amonio
a nitrito parcialmente, para luego oxidar
el amonio en condiciones anaerobias. Ejemplos
de estos diseños son el OLAND, CANON,
SNAD, SHANON (khin 2004) y otros procesos
combinados (Verstraete,1998). Diferentes
configuraciones de uno o dos reactores en
serie, aerobias o anóxicas o combinadas,
han demostrado ser eficientes para la remoción
y aplicables en concordancia con las comunidades
microbianas, sus requerimientos y metabolismos
han sido probados. Algunos de los más
experimentados y utilizados a escala real
son los siguientes: 1) CANON:(Completely
Autotrophic Nitrogen removal Over Nitrite):
proceso que utiliza un solo reactor en el
cual las comunidades microbianas enriquecidas
son autótrofas, fue concebido con
la idea de tratar altas concentraciones
de amonio (500-600 mg N/l). Las reacciones
que intervienen son las siguientes:
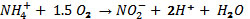
(Khin, 2004), para la nitrificación
(controlada, hasta lograr una relación
NO2-/NH4+de 1.32) y
,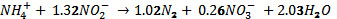
para la reacción
Anammox (Ahn, 2006). Third et al. (2001),
encontraron que en este sistema las bacterias
aerobias oxidadoras de nitrito presentes
en los flóculos experimentan una
doble limitación, compiten con Nitrosomonaspor
el oxígeno y con ANAMMOX por el nitrito.
Por el contrario, las oxidadoras de amonio
tienen una sola limitación: de oxígeno
las Nitrosomonasy de nitrito las ANAMMOX.
El control de la aireación juega
un papel muy importante en el sistema por
la proliferación de oxidadoras de
nitrito cuando hay una concentración
alta de oxígeno disuelto y la inhibición
de oxidadoras aerobias de amonio con bajas
concentraciones (Third, et al., 2001). El
análisis de FISH de la biomasa de
un reactor CANON mostró que el 40%
de la población correspondía
a bacterias aerobias oxidadoras de amonio
y las células ANAMMOX constituían
alrededor del 40% (Jetten , 2004). Otras
ventajas son la reducción del 20%
en emisiones de CO2y baja producción
de lodo. 2) OLAND (Oxigen-Limited Autotrophic
Nitrification Denitrification): definido
como el proceso en el cual el amonio es
oxidado a nitrógeno molecular bajo
condiciones de oxígeno limitadas,
con las cuales se logra la nitrificación
parcial; por lo cual, en realidad, se fundamenta
en los mismos principios del procesos CANON,
siendo su proceso similar pero aplicado
en otras condiciones de reactor, específicamente
en un reactor de biofiltro o de biomasa
adherida; algunos autores consideran a estos
dos como un mismo proceso (Hao, 2002). 3)
SHARON-Anammox: El proceso combinado de
nitrificación parcial con Anammox
en dos reactores separados y en serie, normalmente
llamado SHARON-ANNAMOX, consiste en la transformación
aeróbica controlada del amonio a
nitrito hasta oxidar aproximadamente el
44 % del amonio afluente en un reactor tipo
SHARON para posteriormente en un reactor
sucesivo Anammox ser denitrificado a Nitrógeno
molecular. Es un proceso patentado, basado
en la nitrificación parcial (NH4+?NO2-)
por microorganismos aerobios y Denitrificación
parcial (NO2-?NO?N2?N2) por microorganismos
heterótrofos anaerobios facultativos.
Generalmente el reactor Anammox es del tipo
SBR (Secuencial Batch Reactor). SHARON-ANAMMOX
transforma en primer reactor NH4 + a NO2-
hasta oxidar aproximadamente el 44 % del
NH4+ (van Dongen et al., 2001; Third et
al., 2001) para posteriormente, en un reactor
sucesivo Anammox ser convertido a N2. Se
produce poco lodo y solo requiere el 40
% de la energía de aireación
requerida en un proceso convencional de
remoción de Nitrógeno (Hao
et al., 2002). El efluente del reactor SHARON
modificado contiene, entonces, una mezcla
de amonio y nitrito, ideal para el proceso
Anammox, en el cual estos dos compuestos
son convertidos a nitrógeno gaseoso.
Las aguas residuales ahí tratadas
deben tener concentraciones de amonio superiores
a 0,5 gr./L. No requiere retención
de biomasa (Ahn, 2006). La reacción
en el reactor SHARON se puede generalizar
de la siguiente manera (Khin y Annachate,
2004).:
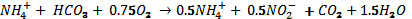
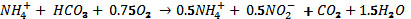
Las plantas instaladas
en diversos países se concentran
en el tratamiento de aguas residuales de
alta tasa, generalmente de origen municipal
y agroindustrial. Los reportes de operación
señalan ventajas, como disminución
en más del 50% de O2 y 25% de fuentes
de carbono externo, comparado con los sistemas
convencionales, así como remociones
entre 60 y 95% del nitrógeno de los
efluentes con cargas contaminantes de más
de 1g N/L (Mulder, 2006; Jardin, 2006; Keeley
2006; Abma , 2007). El uso de reactores
Anammox puede conducir a una reducción
de los costos operacionales de hasta un
90 % (Jetten, 2004). Recientemente la compañía
PAQUES de los Países Bajos ha hecho
un acuerdo para el diseño e instalación
de un sistema para tratamiento de efluentes
para la remoción de amonio usando
el proceso de Anammox, que tiene una capacidad
para la conversión de 11 toneladas
de nitrógeno por día. El tamaño
de la planta es casi diez veces más
grande que la planta más grande construida
hasta ahora. El proceso de Anammox se ha
desarrollado en asociación con la
Universidad Técnica de Delft y la
Universidad Nimega de Radboud. Una diferencia
importante con el sistema convencional de
lodos activados es justamente la conversión
del nitrógeno con el proceso de Anammox
que no consume carbón orgánico,
pero además propone la producción
de biogas. En Brasil se han realizado investigaciones
del uso de Anammox en sistemas para tratamiento
de residuos de ganadería usando inóculos
nativos alcanzando altas tasas de remoción
y se está estudiando el desarrollo
de prototipos usando aguas residuales provenientes
de explotaciones porcinas, con el objetivo
de minimizar el impacto de las aguas residuales
del ganado en los recursos hídricos
(Kunz, 2007). La configuración de
los reactores para diferentes aplicaciones
son descritas en diferentes publicaciones
(Molinuelo, 2009; Furukawa, 2009; Wang,
2009; Chen, 2009); no obstante, en Latinoamérica,
con excepción del Brasil, la tecnología
es poco conocida.
4. CONCLUSIONES
El estudio de los procesos Anammox permite
la construcción de reactores eficientes,
sostenibles y adaptables a las condiciones
locales para la remoción de compuestos
nitrogenados de las aguas residuales domésticas
con el fin de contribuir a la descontaminación
de los cuerpos de aguas receptores.
La interrelación
de las comunidades microbianas en los procesos
del ciclo del N permite esperar que conglomerados
microbianos colocados en reactores especializados
logren la remoción de contaminantes
en los sistemas de tratamiento.
Debido a la diversidad
metabólica que presentan las comunidades
Anammox, es necesario que las investigaciones
propuestas definan las diferentes rutas
metabólicas, sus sustratos y productos
para mejorar su desarrollo e incrementar
la eficiencia en la remoción de nitrógeno
en reactores biológicos.
La investigación
debe enfocarse al aislamiento, enriquecimiento
y el cultivo de cepas locales en las diferentes
latitudes en donde su aplicabilidad sea
pertinente, realizando análisis cuantitativos
para determinar la densidad celular de bacterias
presente en la biomasa producida en los
reactores.
Es importante definir la
diversidad metabólica y funcionalidad
de cada una de las rutas metabólicas
en las cuales las bacterias Anammox intervienen,
entendiéndose como funcionalidad
las razones por las que realiza determinada
ruta.
Como una alternativa sostenible
y de bajo costo, este grupo bacteriano puede
incluirse en los sistemas de tratamiento
en condiciones de escala real, dada su contribución
comprobada de formación de N2 a partir
de especies nitrogenadas presentes en exceso
en las aguas residuales domésticas.
Finalmente, otro punto
de interés particular es determinar
experimentalmente si es posible la conversión
del NH4 - a N2 por bacterias Anammox, sin
adición externa de NO2- (directa
o indirecta).
5. REFERENCIAS BIBLIOGRÁFICAS
Abma, W.R. , Schultz, C.E., Mulder J.W.,
van der Star W.R.L., Strous, M., Tokutomi,
T. y van Loosdrecht, M.C.M. (2007). Full-scale
granular sludge Anammox process. Water Science
& Technology 55(8-9):27.
Ahn, Y-H. (2006). Sustainable nitrogen elimination
biotechnologies: A review. Process Biochemistry
41(8):1709-1721.
Ahn, Y-H y Choi, H.C. (2006). Autotrophic
nitrogen removal from sludge digester liquids
in upflow sludge bed reactor with external
aeration. Process Biochemistry 41(9):1945–1950.
Cervantes-Carrillo, F., Pérez, J.
y Gómez, J.( 2000). Avances en la
eliminación biológica del
nitrógeno de las aguas residuales.
Revista Latinoamericana de Microbiología-México
42(2):73–82.
Cirpus, I.E.Y., Geerts, W., Hermans, J.H.M.,
Op den Camp, H.J.M., Strous, M., Kuenen,
J. G. y Jetten, M.S.M. (2006). Challenging
protein purification from anammox bacteria.
International journal of biological macromolecules
39(1-3):88–94.
Chamchoi, N. y Nitisoravut, S. (2007). Anammox
enrichment from different conventional sludges.
Chemosphere 66(11):2225–2232.
Chen, H., Liu, S., Yang, F., Xue, Y. y Wang,
T. (2009). The development of simultaneous
partial nitrification, ANAMMOX and denitrification
(SNAD) process in a single reactor for nitrogen
removal. Bioresource Technology 100(4):1548-1554.
Daims, H. y Wagner, M.( 2007). Quantification
of uncultured microorganisms by fluorescence
microscopy and digital image analysis. Applied
microbiology and biotechnology 75(2):237–248.
Dalsgaard, T., Thamdrup, B. y Canfield,
D.E. (2005). Anaerobic ammonium oxidation
(anammox) in the marine environment. Research
in Microbiology 156(4):457–464.
Egli, K., Bosshard, F., Werlen, C., Lais,
P., Siegrist, H., Zehnder, A.J.B. y Van
der Meer, J.R. (2003). Microbial composition
and structure of a rotating biological contactor
biofilm treating ammonium-rich wastewater
without organic carbon. Microbial ecology
45(4):419–432.
Francis, C.A., Beman, J.M. y Kuypers, M.M.M.
(2007). New processes and players in the
nitrogen cycle: the microbial ecology of
anaerobic and archaeal ammonia oxidation.
The ISME Journal 1(1):19–27.
Furukawa, K., Inatomi, Y., Qiao, S., Quan,
L., Yamamoto, T., Isaka, K. y Sumino, T.
(2009). Innovative treatment system for
digester liquor using anammox process. Bioresource
Technology 100(22):5437-5443.
Galán, A., Molina, V., Thamdrup,
B., Woebken, D., Lavik, G., Kuypers, M.M.M.
y Ulloa, O. (2009). Anammox bacteria and
the anaerobic oxidation of ammonium in the
oxygen minimum zone off northern Chile.
Deep-Sea Research Part II 56(16):1125–1135.
Galloway, J.N., Townsend, A.R., Erisman,
J.W., Bekunda, M., Cai, Z., Freney, J.R.,
Martinelli, L. A., Seitzinger, S.P. y Sutton,
M.A. (2008). Transformation of the nitrogen
cycle: recent trends, questions, and potential
solutions. Science 320(5878):889.
Gilbride, K.A., Lee, D.Y. y Beaudette, L.A.(
2006). Molecular techniques in wastewater:
Understanding microbial communities, detecting
pathogens, and real-time process control.
Journal of microbiological methods 66(1):1–20.
Gruber, N. y Galloway, J.N. (2008). An Earth-system
perspective of the global nitrogen cycle.
Nature 451(7176):293–296.
Guven, D., Dapena, A., Kartal, B., Schmid,
M.C., Maas, B., van de Pas-Schoonen, K.,
Sozen, S., Mendez, R., Op den Camp, H.J.M.,
Jetten, M.S. M. y others. (2005). Propionate
oxidation by and methanol inhibition of
anaerobic ammonium-oxidizing bacteria. Applied
and Environmental Microbiology 71(2):1066–1071.
Hamersley, M.R., Lavik, G., Woebken, D.,
Rattray, J. E., Lam, P., Hopmans, E.C.,
Damsté, J.S.S., Kruger, S., Graco,
M., Gutiérrez, D. y others. (2007).
Anaerobic ammonium oxidation in the Peruvian
oxygen minimum zone. Limnology and Oceanography
52(3):923.
Hao, X., Heijnen, J.J. y Van Loosdrecht,
M.C.M. (2002). Model-based evaluation of
temperature and inflow variations on a partial
nitrification-ANAMMOX biofilm process. Water
Research 36(19):4839-4849
Hug, T., Gujer, W. y Siegrist, H. (2005).
Rapid quantification of bacteria in activated
sludge using fluorescence in situ hybridization
and epifluorescence microscopy. Water Research
39(16):3837–3848.
Inamori, R., Gui, P., Dass, P., Matsumura,.M.,
Xu, K.Q., Kondo, T., Ebie, Y. y Inamori,
Y. (2007). Investigating CH4 and N2O emissions
from eco-engineering wastewater treatment
processes using constructed wetland microcosms.
Process Biochemistry 42(3):363-373.
Innerebner, G., Insam, H., Franke-Whittle,
I.H. y Wett, B. (2007). Identification of
anammox bacteria in a full-scale deammonification
plant making use of anaerobic ammonia oxidation.
Systematic and Applied Microbiology 30(5):408-412.
Jardin, N., Thö, le D. y Wett, B. (2006).
Treatment of Sludge Return Liquors: Experiences
from the Operation of Full-Scale Plants.
Proceedings of the Water Environment Federation
2006:5237-5255.
Jetten, M.S.M., Cirpus, I., Kartal, B.,
van Niftrik, L., van de Pas-Schoonen, K.T.,
Sliekers, O., Haaijer, S., van der Star,
W., Schmid, M., van de Vossenberg, J., Schmidt,
I., Harhangi, H., van Loosdrecht, M., Gijs
Kuenen, J., Op den Camp, H. y Strous, M.
(2005. 1994-2004): 10 years of research
on the anaerobic oxidation of ammonium.
Biochemical Society Transactions 33(Pt 1):119-123.
Jetten, M.S.M., Wagner, M., Fuerst, J.,
van Loosdrecht, M., Kuenen, G. y Strous,
M. (2001). Microbiology and application
of the anaerobic ammonium oxidation(‘anammox’)
process. Current Opinion in biotechnology
12(3):283–288.
Jin, R-c., Hu, B-l., Zheng, P., Qaisar,
M., Hu, A-h y Islam, E. (2008). Quantitative
comparison of stability of ANAMMOX process
in different reactor configurations. Bioresource
Technology 99(6):1603-1609.
Kartal, B., Kuypers, M.M.M., Lavik, G.,
Schalk, J., Op den Camp, H.J.M. y Jetten(2007).
Anammox bacteria disguised as denitrifiers:
nitrate reduction to dinitrogen gas via
nitrite and ammonium. Environmental Microbiology
9(4):635-642.
Keeley, J. (2006). Balancing technological
innovation and environmental regulation:
an analysis of Chinese agricultural biotechnology
governance. Environmental Politics 15(2):293.
Khin, T. y Annachhatre, A.P. (2004). Novel
microbial nitrogen removal processes. Biotechnology
advances 22(7):519–532.
Kindaichi, T., Tsushima, I., Ogasawara,
Y., Shimokawa, M., Ozaki, N., Satoh, H.
y Okabe, S. (2007). In situ activity and
spatial organization of anaerobic ammonium-oxidizing
(anammox) bacteria in biofilms. Applied
and Environmental Microbiology 73(15):4931.
Kuenen, J.G. (2008). Anammox bacteria: from
discovery to application. Nat Rev Micro
6(4):320-326.
Kunz, A., Vanotti, M., Szogi, A., Garcia,
M-C., Francisco, S. y Moreira, H. (2007).
Development of ANAMMOX Process For Animal
Waste Treatment: Experiences in Brazil.
American Society of Agricultural and Biological
Engineers. p 16-19.
Maier, R.M., Pepper, I.L. y Gerba, C.P.
(2000). Environmental Microbiology. PRESS
A, editor. San Diego, California.
McMahon, K.D., Gu, A.Z., Nerenberg, R. y
Angenent, L.T. (2007). Molecular Methods
in Biological Systems. Water Environment
Research 79:1109-1151.
Molinuevo, B., García, M.C., Karakashev,
D. y Angelidaki, I. (2009). Anammox for
ammonia removal from pig manure effluents:
Effect of organic matter content on process
performance. Bioresource Technology 100(7):2171-2175.
Moter, A. y Göbel, U.B. (2000). Fluorescence
in situ hybridization (FISH) for direct
visualization of microorganisms. Journal
of microbiological methods 41(2):85–112.
Mulder, A., Graaf, A.A., Robertson, L.A.
y Kuenen, J.G. (1995). Anaerobic ammonium
oxidation discovered in a denitrifying fluidized
bed reactor. FEMS Microbiology Ecology 16(3):177-184.
Mulder, J.W., Duin, J.O.J., Goverde, J.,
Poiesz, W. G., van Veldhuizen, H.M., van
Kempen, R. y Roeleveld, P. (2006). Full-Scale
Experience with the Sharon Process through
the Eyes of the Operators. Proceedings of
the Water Environment
Federation 2006:5256-5270.
Nieder, R. y Benbi, D.K. (2008). Carbon
and Nitrogen Cycles in Terrestrial Ecosystems.
Carbon and Nitrogen in the Terrestrial Environment.
p 45-80.
Noophan L.P, Sripiboon S, Damrongsri, M.
y Munakata-Marr, J. (2009). Anaerobic ammonium
oxidation by Nitrosomonas spp. and anammox
bacteria in a sequencing batch reactor.
Journal of Environmental Management 90(2):967-972.
Pilcher, H. (2005). Microbiology: Pipe dreams.
Nature 437(7063):1227-1228.
Qiao, S., Kawakubo, Y., Cheng, Y., Nishiyama,
T., Fujii, T. y Furukawa, K. (2009). Identification
of bacteria coexisting with anammox bacteria
in an upflow column type reactor. Biodegradation
20(1):117-124.
Reginatto, V., Teixeira, R.M., Pereira,
F., Schmidell, W., Furigo, Jr. A., Menes,
R., Etchebehere, C. y Soares, H.M. (2005).
Anaerobic ammonium oxidation in a bioreactor
treating slaughterhouse wastewater. Brazilian
Journal of Chemical Engineering 22:593–600.
Sánchez-Melsió, A., Cáliz,
J., Balaguer, M.D., Colprim, J. y Vila,
X. (2009). Development of batch-culture
enrichment coupled to molecular detection
for screening of natural and man-made environments
in search of anammox bacteria for N-removal
bioreactors systems. Chemosphere 75(2):169-179.
Sánchez, J. y Sanabria, J. (2009).
Metabolismos microbianos involucrados en
procesos avanzados para la remoción
de Nitrógeno, una revisión
prospectiva. Revista Colombiana de Biotecnología
11(1):114-124.
Sanz, J.L. y Köchling, T. (2007). Molecular
biology techniques used in wastewater treatment:
An overview. Process Biochemistry 42(2):119-133.
Schmid, M., Walsh, K., Webb, R., Rijpstra,
W. I., van de Pas-Schoonen, K., Verbruggen,
M.J., Hill, T., Moffett, B., Fuerst, J.,
Schouten, S., Sinninghe Damsté, J.S.
, Harris, J., Shaw, P., Jetten, M. y Strous,
M. (2003). Candidatus “Scalindua brodae”,
sp. nov., Candidatus “Scalindua wagneri”,
sp. nov., Two New Species of Anaerobic Ammonium
Oxidizing Bacteria. Systematic and Applied
Microbiology 26(4):529-538.
Schmidt, I., Sliekers, O., Schmid, M., Cirpus,
I., Strous, M., Bock, E., Kuenen, J.G. y
Jetten, M.S.M. (2002). Aerobic and anaerobic
ammonia oxidizing bacteria - competitors
or natural partners? FEMS Microbiology Ecology
39(3):175-181. .
Strous, M., Van Gerven, E., Zheng, P., Kuenen,
J.G. y Jetten, M.S.M. (1997). Ammonium removal
from concentrated waste streams with the
anaerobic ammonium oxidation (Anammox) process
in different reactor configurations. Water
Research 31(8):1955–1962.
Third, K.A., Sliekers, A.O., Kuenen, J.G.
y Jetten, M.S.M. (2001). The CANON System
(Completely Autotrophic Nitrogen-removal
Over Nitrite) under Ammonium Limitation:
Interaction and Competition between Three
Groups of Bacteria. Systematic and Applied
Microbiology 24(4):588-596.
Towsend, A.R., Howarth, R.W., Bazzaz, F.A.,
Booth, M.S., Cleveland, C.C., CCollinge,
S.K., Dobson, A.P., Epstein, P.R., Holland,
E.A., Keeney, D.R., Mallin, M.A., Rogers,
C.A., Wayne, P. y Wolf, A.H. (2003). Human
health effects of a changing flobal nitrogen
cycle. The Ecological Society of America
1:240-246.
Tsushima, I., Ogasawara, Y., Kindaichi,
T., Satoh, H. y Okabe, S. (2007). Development
of high-rate anaerobic ammonium-oxidizing
(anammox) biofilm reactors. Water Research
41(8):1623-1634.
Van de Graaf, A.A., Mulder, A., De Bruijn,
P., Jetten, M.S., Robertson, L.A. y Kuenen,
J.G. (1995). Anaerobic oxidation of ammonium
is a biologically mediated process. Applied
and environmental microbiology 61(4):1246.
Van Dongen, L., Jetten, M.S.M. y Van Loosdrecht,
M.C.M. (2001a). The combined SHARON/Anammox
process.
Van Dongen, U., Jetten, M.S.M., Van Loosdrecht,
M.C.M. y others. (2001b). The SHARON®-Anammox®
process for treatment of ammonium rich wastewater.
Water science and technology 44(1):153–160.
Verstraete, W. y Philips, S. (1998). Nitrification-denitrification
processes and technologies in new contexts.
Environmental Pollution 102(1, Supplement
1):717-726.
Wang, T., Zhang, H., Yang, F., Liu, S.,
Fu, Z. y Chen, H. (2009). Start-up of the
Anammox process from the conventional activated
sludge in a membrane bioreactor. Bioresource
Technology 100(9):2501-2506.
Warakomski, A., Kempen, Rv. y Kios, P. (2007).
Microbiology/Biochemistry of the Nitrogen
Cycle. Innovative Process Applications.
Moving forward wastewater biosolids sustainability:
technical, managerial, and public synergy.
New Brunswick: GMSC. p 277-285.
|
