| |
1.
INTRODUCCIÓN
En Colombia, según el informe de
la Asociación de Cultivadores de
Caña de Azúcar - Asocaña
(Capurro, 2007), existen más de 200.000
hectáreas sembradas con caña,
que produjeron en el año 2006 aproximadamente
21 millones de toneladas de caña,
2,5 millones de toneladas de azúcar
y 316.000 toneladas de etanol. Estas cifras
dan una idea del extenso uso de plaguicidas
que tiene esta industria para el control
de plagas, malezas y, ocasionalmente, como
madurantes. El Diurón, el 2,4 D y
la Ametrina son plaguicidas altamente tóxicos,
persistentes en el suelo, aguas superficiales
y aguas subterráneas, que generan
alta morbilidad, afectando el ambiente y
los seres vivos (Mayorga e Izquierdo, 2008).
Igualmente, en ocasiones se ha encontrado
que sus productos de degradación
exhiben una toxicidad más alta y
son aún más persistentes en
el medio que el compuesto original. Así,
estos compuestos poseen un potencial significativo
de toxicidad y pueden llegar a contaminar
todas las esferas del medio ambiente (Sorensen
et al., 2003).
Para disminuir los efectos
producidos por los plaguicidas se han estudiado
tecnologías biológicas, químicas
y físicas. Sin embargo, en su mayoría
estas tecnologías no son aplicables,
ya sea por su alto costo, su baja eficiencia
o porque simplemente no funcionan. No obstante,
en los últimos años se ha
trabajado en la búsqueda de tecnologías
que permitan una destrucción total
de la sustancia contaminante o en su defecto
una modificación en la estructura
química de la misma que le permita
hacerla más biodegradable y facilite
la utilización de sistemas biológicos
para tratar estas sustancias en particular.
Una alternativa es facilitar el acople de
sistemas fotocatalíticos –
biológicos, los cuales se están
aplicando a gran escala en países
europeos con excelentes resultados (Araña
et al., 2007).
La biodegradabilidad de
la mezcla de plaguicidas se evaluó
a flujo continuo en un Filtro Percolador,
construido con elementos de fácil
adquisición localmente, y en un Humedal
de Flujo Subsuperficial con plantas nativas,
lo que permitió seleccionar la tecnología
más adecuada para el acople. Oller
et al. (2007) y Lapertot et al.(2007), realizaron
algunos estudios sobre acoples sin enfatizar
la selección del tratamiento biológico
ni el estudio de tecnologías alternas,
mostrando de manera directa el acople. Igualmente,
se ha trabajado con plaguicidas en su presentación
analítica como ingredientes activos
y no con la formulación comercial,
en las cantidades y proporciones utilizadas
en los ingenios azucareros.
Algunos de los procesos
de degradación biológica para
estos compuestos tóxicos son extremadamente
lentos. Así, la degradación
parcial del Diurón lleva a una acumulación
de 3,4-dicloroanilina por la ruta aerobia
(Sorensen et al., 2003), identificándose
éste y otros intermedios metabólicos
en suelos de cultivos de algodón,
arroz y caña de azúcar, entre
otros (Widehem et al., 2002). Sahinkaya
y Dilek en el año 2007 realizaron
estudios de la cinética de biodegradación
de 2,4- diclorofenol utilizando dos cultivos
mixtos de microorganismos, uno de ellos
aclimatado al sustrato de interés.
La mayor tasa de degradación se obtuvo
con el lodo aclimatado y se modeló
el proceso mediante la ecuación de
Haldane, cuyos parámetros se calcularon
utilizando una técnica de mínimos
cuadrados no lineal.
Por otro lado, Oller et al. (2007) realizaron
el acople de un sistema fotocatalítico
– biológico, donde los compuestos
biodegradables generados en el proceso oxidativo
preliminar fueron mineralizados un 90% en
un Filtro Percolador.
En un sistema combinado
de oxidación avanzada y un sistema
biológico de lodos activados (Lafi
et al., 2006) alcanzaron una reducción
del 95% de COD (carbono orgánico
disuelto) para el plaguicida Deltametrina
cuando un sistema O3/UV alimentó
a un biorreactor. (Parra et al., 2000) realizaron
estudios sobre el acople de sistemas fotocatalíticos
y biológicos del metobromuron e isoproturon
encontrando factibilidad del tratamiento
del isoproturon por este sistema combinado
mas no para el otro plaguicida debido a
la generación de metabolitos tóxicos.
(Araña et al., 2007)
estudiaron a escala de laboratorio la combinación
de Procesos Avanzados de Oxidación
(AOP’s) y Biológico usando
un humedal para el tratamiento de los plaguicidas
Folimat, Ronstar, pyrimethanil y triadimenol,
encontrando que el sistema biológico
solo no es efectivo para su tratamiento,
mientras que el acople da mejores resultados
en cuanto a la toxicidad resultante en la
fotocatálisis.
(Muñoz et al., 2006)
presentan un modelo de tratamiento de aguas
residuales mediante el acople de AOP’s
- biológico para un agua residual
industrial usando las fotocatálisis
heterogénea y homogénea y
acoplando el efluente con una planta de
tratamiento de aguas residuales municipales.
La selección entre
los procesos biológicos Filtro Percolador
y Humedal permitirá determinar para
estas mezclas de plaguicidas usadas en los
ingenios azucareros la alternativa más
viable para un posterior acople con un sistema
de oxidación avanzada, AOP’s.
2. MATERIALES Y MÉTODOS
Para la evaluación de los procesos
de tratamiento biológico se realizaron
ensayos en condiciones de flujo continuo,
donde se utilizaron dos reactores a escala
de laboratorio, un Filtro Percolador y un
Humedal construido de flujo subsuperficial,
midiéndose la degradación
de la mezcla en términos de la Demanda
Química de Oxígeno (DQO) del
efluente tratado, referida a la concentración
de este parámetro en el afluente.
Los microorganismos y plantas
contenidos en los reactores se encontraban
en condiciones ambientales apropiadas para
su normal desarrollo, valorados en términos
de pH, temperatura y nutrientes, promoviendo
así la biodegradación de los
plaguicidas. Se analizaron diariamente como
parámetros de control del proceso:
pH, temperatura y carga orgánica
(partiendo de los valores de caudal de alimentación
de los reactores y de la concentración
del agua residual).
Para la alimentación
de los sistemas se proporcionó un
caudal constante de 20 ml/min, usando para
el filtro percolador una bomba peristáltica
Cole-Parmer de caudal variable (rango de
operación de 10 a 50 ml/min), y para
el humedal un dosificador de suero. Los
análisis de DQO se realizaron en
un espectrofotómetro UV-Visible (UV-160A
Shimadzu), usando una solución de
Dicromato de potasio como agente oxidante
en un medio fuertemente ácido. Los
análisis de laboratorio fueron realizados
en el Laboratorio de Química Ambiental
del Área de Ingeniería Sanitaria
y Ambiental de la Universidad del Valle,
Colombia.
El agua residual agroindustrial sintética
con plaguicidas estudiada consta de una
mezcla de plaguicidas que simula los efluentes
generados en el lavado de equipos de fumigación
de cultivos de caña de azúcar
y contiene, en su presentación comercial,
por cada 150 L, 2,5 kg de Diuron (Karmex
WG), 1,5 L de 2,4 D (2.4 D Amina 720) y
3,0 L de Ametrina (Igram). Además
de 0,15 L de Inex-A (Cosmoagro) y 0,1 kg
de Cosmoaguas (Cosmoagro), ambos coadyuvantes.
La evaluación del
Humedal y del Filtro Percolador durante
la experimentación se realizó
en dos etapas: i) se realizó la alimentación
con un agua residual doméstica sintética,
en ausencia de plaguicidas; y, ii) se alimentó
con una combinación de agua residual
doméstica sintética y agua
residual agroindustrial sintética
con plaguicidas, en una relación
de 1 a 9 (1 parte de agua residual agroindustrial
por 9 partes de agua residual doméstica)
en términos de mg O2/L de DQO.
El agua residual doméstica
sintética simula un agua residual
con concentración de 300 mg O2/L
de DQO y se compone de azúcar como
fuente de materia orgánica, macronutrientes
(N y P), elementos traza necesarios para
el crecimiento y desarrollo microbiano y
alcalinizante que garantiza la capacidad
búffer.
La preparación del
agua residual doméstica sintética
se realizó mediante la adición
de tres soluciones (por cada
Tabla 1. Solución Madre Y Elementos
Traza (Composición Para 10 Litros
de Solución).
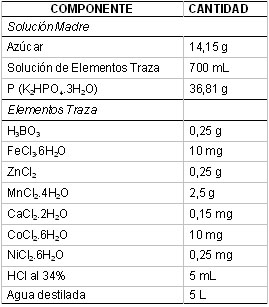
ii) 4,28 mL de solución
de Nitrógeno (solución concentrada
de Úrea de 10 g/L), que permitió
adicionar este nutriente al agua residual,
garantizando una relación DQO:N de
350:5, con el fin de proporcionar nitrógeno
suficiente para garantizar a los microorganismos
efectuar sus procesos metabólicos
de forma óptima. iii) 150 mL de Solución
Alcalinizante (solución concentrada
de bicarbonato de sodio de 10 g NaHCO3/L),
obteniendo una relación DQO: NaHCO3
de 1:0,5, que garantiza una capacidad tampón
suficiente para evitar caídas bruscas
del pH.
El Filtro Percolador consistió
en un cilindro de Plasti-glass de 314 cm2
de área transversal, con un brazo
distribuidor rotatorio de 8 cm de longitud
y un medio filtrante plástico de
34,6 cm de altura. El medio soporte eran
tubos anillados de configuración
aleatoria (coraza de cable eléctrico
de 3/4 de pulgada de diámetro) y
ocupó un volumen de 10,56% del reactor.
En la Figura 1 se presenta el esquema del
Filtro Percolador y su sistema de alimentación.
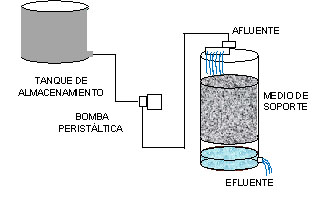
Figura 1. Diagrama del
Filtro Percolador y Sistema de Alimentación
Para la alimentación
del Filtro Percolador se empleó un
tanque de almacenamiento plástico
de 50 L y una bomba peristáltica
marca Cole–Parmer instrument CO, Modelo
No 7553 – 70, la cual mantuvo un caudal
constante de 20 ml/min. Como inóculo
para el reactor se utilizó lodo activado,
proveniente de una planta de tratamiento
de aguas residuales domésticas, y
se evaluó con el propósito
de determinar su posible utilización
como inóculo para el reactor.
El Humedal de Flujo Subsuperficial
consistió en un cajón de soporte,
elaborado en fibra de vidrio, con ángulos
de acero en los empalmes de la estructura
a lo largo y ancho de las caras, para darle
mayor estabilidad y rigidez. El ingreso
y salida del sustrato se realizó
mediante cámaras ubicadas en ambos
extremos de la unidad, con pantallas perforadas
para lograr una distribución y recolección
uniforme del agua residual. En la Figura
2 se presenta un esquema del Humedal de
Flujo Subsuperficial evaluado y su sistema
de alimentación.
Para la siembra del humedal
se seleccionó una planta nativa de
la región del Valle del Cauca (Phragmites
communis), cuya presencia es común
en zonas cercanas a los cultivos de caña
de azúcar. Las plantas que fueron
extraídas de un sistema de tratamiento
de aguas residuales industriales tenían
una altura promedio de 50 cm y un lecho
de raíces parcialmente desarrollado.
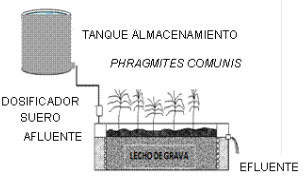
Figura 2. Diagrama del Humedal de Flujo
Subsuperficial y Sistema de Alimentación
La alimentación del sistema se realizó
mediante el almacenamiento del sustrato
en un tanque alto de asbesto-cemento con
capacidad de 1.000 L, siendo suministrado
por gravedad a la cámara de entrada
del humedal. El caudal se mantuvo constante
en 20 ml/min mediante un dosificador de
suero.
3. RESULTADOS Y DISCUSIÓN
El agua residual agroindustrial sintética
se preparó con una mezcla de tres
plaguicidas y dos coadyuvantes, en concentraciones
tales que simulan las mezclas aplicadas
para el control de malezas en los ingenios
azucareros. La mezcla está compuesta
de 2,5 kg de Diurón (Karmex WG),
1,5 L de 2,4 D (2,4 D Amina 720), 3,0 L
de Ametrina (Igram), 0,15 L de Inex-A (Cosmoagro)
y 0,1 kg de Cosmoaguas (Cosmoagro) por cada
150 L de preparación.
Según lo reportado
por Pinillos y Pinto (2007), de la variedad
de productos y mezclas de productos usados
en la agroindustria azucarera, la mezcla
de plaguicidas evaluada contiene los tres
plaguicidas más usados en el cultivo
de la caña de azúcar en su
mayor concentración, por lo que se
espera sea dentro de las usadas la de mayor
toxicidad y dificultad para tratar . De
ser factible su biotratabilidad se esperaría
que también lo fuesen las otras mezclas,
ya que al ser menos concentradas son menos
tóxicas (Eweis, 1999).
En la primera etapa de
la experimentación, los reactores
biológicos fueron alimentados con
agua residual doméstica sintética
en ausencia de plaguicidas, preparada con
soluciones de DQO (solución madre),
úrea y alcalinidad, en relaciones
350:5:175 y una concentración en
DQO de 300 mg O2/L. Este periodo inicial
de alimentación se realizó
con la finalidad de aclimatar los microorganismos
al agua residual y a las condiciones presentes
en los biorreactores.
Una vez aclimatados los
microorganismos a las nuevas condiciones
del biorreactor, en la segunda etapa de
experimentación (a partir del día
9 y hasta el final del ensayo), fueron alimentados
con una mezcla de agua residual doméstica
sintética - agua residual agroindustrial
sintética con plaguicidas, de acuerdo
con a la proporción establecida (1:9).
La DQO se mantuvo constante en 300 mg O2/L.
Se realizaron mediciones
diarias de la DQO, el pH y la temperatura
en cada uno de los reactores. Las Figuras
3 y 4 muestran el seguimiento de DQO y el
porcentaje de reducción de DQO en
el Filtro Percolador y en el Humedal de
Flujo Subsuperficial, respectivamente.
En el Filtro Percolador se observó,
desde el día 11 hasta el final del
ensayo (día 43), una vez alcanzada
la estabilidad para el tratamiento de una
agua residual doméstica sintética-mezcla
de plaguicidas, que las eficiencias de reducción
de DQO estuvieron entre 54,3% y 38,2%, con
un valor promedio del 46,2%. Igualmente,
los resultados mostraron que la DQO de entrada
presentó una concentración
máxima de 300,8 mg O2/L y una mínima
de 248,8 mg O2/L, mientras que
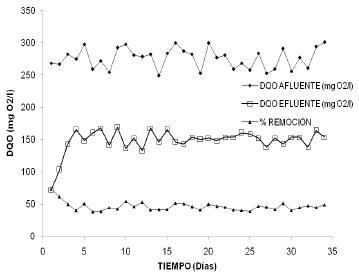
Figura 3. Seguimiento
de DQO y porcentaje de reducción
de DQO en el Filtro Percolador
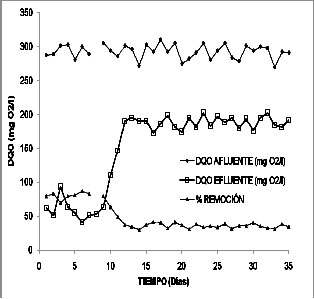
Figura 4. Seguimiento de DQO y porcentaje
de reducción de DQO en el Humedal
de Flujo Subsuperficial
la DQO del efluente presenta un máximo
de 168,9 mg O2/L y un mínimo de 132,5
mg O2/L.
En cuanto a los parámetros
de funcionamiento de este reactor, la carga
hidráulica estuvo constante en 0,92
m3/m2.día y la carga orgánica
varió en el rango de 0,49 a 0,56
kg .DQO/m3.día, presentado un valor
promedio de 0,53 kg.DQO/m3.día. Comparando
estos valores con los recomendados en la
literatura (Romero, 2004), se observa que
la carga hidráulica corresponde a
una tasa baja o estándar (ubicada
en el intervalo de 0,5 a 2,5 m3/m2.día),
y que la carga orgánica corresponde
a una operación de tasa media, que
se ubica en el intervalo de 0,32 a 1,8 m3/m2.
Estos niveles de carga hidráulica
y orgánica son apropiados para afluentes
tóxicos y de concentración
variable; sin embargo, tienen como desventajas
la posible generación de olores y
proliferación de moscas, como se
observó en el ensayo (Romero, 2004).
Por otro lado, el Humedal
de Flujo Subsuperficial presentó
disminuciones en la concentración
de DQO del orden del 35,4%, con un máximo
de 41,0% y un mínimo de 30,1%, para
el reactor en condiciones estables de tratamiento
de agua residual doméstica sintética-mezcla
de plaguicidas (aproximadamente después
del día 13 y hasta el día
43 cuando finalizó el ensayo). El
valor máximo de concentración
de DQO en el afluente fue de 309,5 mg O2/L
y el mínimo de 269,6 mg O2/L. Para
el caso del efluente, el máximo en
concentración de DQO fue de 201,9
mg O2/L y mínimo de 172,4 mg O2/L.
Éste se operó con una carga
hidráulica superficial constante
de 800 m3/ha.día y una carga orgánica
en el rango de 0,22 a 0,25 kg.DQO/ha.día,
con un valor promedio de 0,23 kg.DQO/ha.día.
Estas cargas se encuentran entre los rangos
recomendados por Romero (2004), quien sugiere
cargas hidráulicas superficiales
entre 470 y 1.870 m3/ha.día y cargas
orgánicas menores a 112 kg.DQO/ha.día
para Humedales de Flujo Subsuperficial.
Estos resultados muestran
que el Filtro Percolador presentó
una mayor remoción de DQO que el
Humedal de Flujo Subsuperficial debido posiblemente
a que en la fracción orgánica
del suelo del humedal se presentan fenómenos
de adsorción de los plaguicidas y
de los metabolitos de biotransformación,
generando, por un lado, acumulación
e incremento de la toxicidad sobre los microorganismos
(Mc Donald et al., 1999), y por el otro,
disminución de la biodisponibilidad
de los plaguicidas, limitando de esta manera
el desarrollo de cualquier fenómeno
de biodegradación (Gaultier et al.,
2007).
Pinillos y Pinto en el
año 2007 siguieron la biodegradabilidad
por DQO de la mezcla de plaguicidas estudiada
en el presente ensayo, empleando reactores
de lodos activados en batch. Obtuvieron
una biodegradación del 18,86% para
un periodo de 28 días, valor significativamente
menor a los obtenidos en el Filtro Percolador
y el Humedal de Flujo Subsuperficial, 46,2
y 35,4%, respectivamente (tiempo de retención
hidráulico de 2 días).
Esta diferencia en los
niveles de biodegradación se debe
al régimen de flujo continuo en el
cual operan el Filtro Percolador y el Humedal
de Flujo Subsuperficial, pues el hecho de
que constantemente se tenga entrada y salida
de flujo promueve fenómenos de lavado
dentro de los reactores, evitando la acumulación
de metabolitos tóxicos dentro de
ellos (Levenspiel, 1999). En un reactor
en batch, ante la ausencia de entrada y
salida de flujo, los metabolitos generados
en la biotransformación de los plaguicidas
se acumulan dentro del reactor (Levenspiel,
1999), generando inhibición sobre
las diferentes poblaciones de microorganismos
encargados de la biodegradación de
los plaguicidas (Becerra y Durán,
2004).
Otro factor que influye
en la diferencia de los porcentajes de biodegradación
observada en los reactores en batch frente
a los reactores de flujo continuo es el
hecho de que, en estos últimos, la
entrada continua de flujo aporta un suministro
constante de alimento a los microorganismos,
permitiéndoles mantener tasas de
crecimiento constantes correspondientes
a un crecimiento en fase exponencial, en
donde se presentan altos consumos de sustrato
- plaguicidas en este caso - (Metcalf y
Eddy, 1998). En cuanto a los reactores en
bacth, el suministro de alimento se presenta
sólo al inicio, lo cual hace que
la tasa de crecimiento microbiano varíe
a lo largo del ensayo, dependiendo de la
disponibilidad instantánea de alimento.
Después de cierto periodo de tiempo,
el alimento disponible empieza a escasear
(la porción biodegradable de los
plaguicidas ha desaparecido, transformándose
en metabolitos tóxicos y poco biodegradables),
por lo cual la tasa de crecimiento microbiano
disminuye hasta el punto de presentarse
fases endógenas de decrecimiento
microbiano, caracterizadas por un consumo
nulo de sustrato (Romero, 2004).
Al comparar ambos reactores,
en términos de la inhibición
presentada debido a la toxicidad de la mezcla
estudiada (tomada como la relación
entre el porcentaje de reducción
para el agua residual doméstica sintética
- mezcla plaguicidas y el porcentaje de
reducción para el agua residual doméstica
sintética), se puede observar que
en el Filtro Percolador se presentó
un 40,3% de inhibición sobre los
microorganismos, mientras que en el Humedal
de Flujo Subsuperficial la inhibición
fue del 55,0%. Este resultado muestra que
el Filtro Percolador fue menos susceptible
frente al choque tóxico causado por
los plaguicidas sobre los microorganismos,
lo cual redunda en mayores eficiencias en
reducción de DQO. La razón
de este fenómeno puede estar en la
naturaleza de los tóxicos estudiados
(herbicidas), los cuales afectan directamente
las plantas del humedal (Lambert et al.,
2005); aunque si bien algunos autores afirman
que las plantas no son directamente las
responsables de la reducción de DQO,
éstas sirven de sustento para los
microorganismos a través relaciones
simbióticas en los rizomas (Vimazal,
2007). Este efecto no se presenta en el
Filtro Percolador debido a que en éste
el crecimiento de los microorganismos no
depende en manera alguna de especies vegetales.
Se resalta que durante
el tiempo de ensayo los microorganismos
en el Filtro Percolador presentaron niveles
de pH entre 6,93 y 7,88 unidades y en el
Humedal de Flujo Subsuperficial en el rango
de 6,91 a 7,87 unidades, valores que se
encuentran dentro del nivel de tolerancia
cerca del rango óptimo. En general,
los microorganismos toleran niveles de pH
entre 5,0 y 9,0 unidades, mientras que el
rango de pH óptimo se sitúa
entre 6,5 y 7,5 unidades (García,
2001).
Igualmente la temperatura
presentó valores entre 20,0 y 24,0°
C para el Filtro Percolador y 20,1 y 24,0°
C para el Humedal de Flujo Subsuperficial,
favoreciendo el normal desarrollo de los
microorganismos Mesófilos que se
caracterizan por altas eficiencias en procesos
de degradación. El intervalo de temperatura
para el desarrollo de microorganismos Mesófilos
varía entre 20 y 50 °C (García,
2001). Las variaciones de temperatura afectan
los requerimientos de oxígeno en
el proceso aerobio, la producción
de lodos y el volumen que necesita el reactor
biológico; se estima que la temperatura
máxima para obtener una actividad
biológica aerobia eficiente es de
38° C.
En cuanto al suministro de nutrientes, durante
la realización de la prueba de biotratabilidad
de aguas residuales con contenido de plaguicidas
en el Filtro Percolador y en el Humedal
de Flujo Subsuperficial, los microorganismos
tuvieron la cantidad suficiente de micro
y macro-nutrientes, en formas fácilmente
asimilables; por lo tanto, no se consideraron
como un factor limitante dentro del proceso
biológico.
De esta manera, los resultados
presentan al Filtro Percolador como la mejor
alternativa entre las evaluadas para el
tratamiento de aguas residuales agroindustriales
con contenido de plaguicidas. No obstante,
y a pesar de que los porcentajes de reducción
para el Filtro Percolador se mantuvieron
por encima de los porcentajes de reducción
obtenidos en el Humedal de Flujo Subsuperficial,
ninguna de las tecnologías evaluadas
puede ser usada como proceso único
de tratamiento para este tipo de agua residual
pues no alcanzan a remover el 80% exigido
por la legislación colombiana de
vertimientos líquidos (Ministerio
de Agricultura, 1984) y seguramente los
efluentes tendrán concentraciones
de plaguicidas nocivas para el medio ambiente
y la salud del ser humano.
A partir de los resultados
obtenidos de biotratabilidad de las aguas
residuales con contenido de plaguicidas
de la agroindustria azucarera se seleccionó
el Filtro Percolador como la alternativa
de tratamiento biológico para utilizar
conjuntamente con reactores fotocatalíticos
en un sistema acoplado, debido a que presentó
la mayor eficiencia de reducción
de DQO, alcanzando un 44,8%, frente a un
35,4% obtenida por el Humedal de Flujo Subsuperficial.
4. CONCLUSIONES
Durante el seguimiento de biotratabilidad
de los plaguicidas Diurón, Ametrina
y 2,4-D, los reactores biológicos
contaron con adecuadas condiciones medioambientales
de temperatura, pH y suministro de nutrientes,
por lo cual se puede decir que estos factores
no fueron limitantes para la degradación
de los plaguicidas.
El reactor biológico
que presentó la mayor eficiencia
en reducción de DQO en el tratamiento
de las aguas residuales agroindustriales
con contenido de plaguicidas fue el Filtro
Percolador, alcanzando un 44,8% frente a
un 35,4% del Humedal de Flujo Subsuperficial.
El Filtro Percolador es
menos susceptible que el Humedal de Flujo
Subsuperficial frente al choque tóxico
causado por los plaguicidas. Esto se debe
básicamente a dos fenómenos
que potencializan la toxicidad de los plaguicidas
sobre los microorganismos del Humedal: i)
toxicidad de los plaguicidas (herbicidas)
sobre las plantas del humedal; y, ii) Absorción
y acumulación de los plaguicidas
y metabolitos sobre la fracción orgánica
del suelo empleado en el humedal.
La mezcla de los plaguicidas
Diurón, Ametrina y 2,4 D no es tratable
en sistemas biológicos bajo las condiciones
estudiadas debido al efecto inhibitorio
que estos compuestos ejercen sobre la población
de microorganismos encargados de su biodegradación.
La no factibilidad de biodegradabilidad
de la mezcla de Diurón, Ametrina
y el 2,4 D y los coadyuvantes Inex y Cosmoaguas
acentúan los problemas de biomagnificación
en el medio ambiente, sobre todo en periodos
de tiempo relativamente largos.
La poca biotratabilidad
de los herbicidas Diurón, 2,4-D,
y Ametrina muestra el escaso potencial de
las tecnologías biológicas
como sistemas únicos de tratamiento
de aguas residuales con contenido de estas
sustancias. Sin embargo, realizar acoples
con otros procesos previos de tratamiento,
tal como la fotocatálisis, podría
potenciar el uso de los procesos biológicos
como etapa final de tratamiento, ya que
un pretratamiento fotocatalítico
permite alterar las características
de toxicidad y biodegradabilidad de estas
sustancias.
Para el acople con sistemas
Fotocatalíticos se puede seleccionar
el Filtro Percolador como tratamiento biológico
por presentar el mayor porcentaje de degradación
(44,8%).
5. AGRADECIMIENTOS
Los autores desean expresar sus agradecimientos
a la Escuela Politécnica Federal
de la Laussane - EPFL y al Fondo de Cooperación
Suiza - DDC (Direction Du Development et
de la Cooperation) por la financiación
del proyecto Biosolar Detox (Development
of a coupled solar-biological system for
the desinfection and elimination of organic
contaminants in drinking and wastewaters
in rural areas of Colombia) y al Grupo de
Gestión GAOX por su colaboración
y apoyo.
6. REFERENCIAS BIBLIOGRÁFICAS
Araña, J., Garriga, C., Fernández,
J.A., Herrera, J.A., Ortega, J.M., Doña,
J.P. y Pérez, J. (2007). Combining
TiO2- photocatalysis and wetland reactors
for the efficient treatment of pesticides.
Chemosphere. 71, (4), 788-794.
Becerra, D. Durán, L. (2004). Factibilidad
de Biodegradación del Insecticida
Imidacloprid y Eva luación de su
Movilidad en un Suelo. Trabajo de Grado,
Universidad del Valle.
Capurro, L.F. (2007). Informe Anual Sector
Azucarero de Colombia año: 2006-2007.
Asociación de Cultivadores de Caña
de Azúcar - Asocaña.
Eweis, J. B., Ergas, S., Chang, D. y Schroeder,
E. (1999). Principios de Biorrecuperación.
McGraw – Hill, España. 50-66.
García, N. (2001). Bioremediación.
Universidad de Cuenca, Centro de Estudios
Ambientales. 15-17.
Gaultier, J., Farenhorsta, A., Cathcartb,
J.y Goddard, T. (2007). Degradation of [carboxyl-14C]
2,4-D and [ring-U-14C] 2,4-D in 114 agricultural
soils as affected by soil organic carbon
content. Soil Biology & Biochemistry.
40, (2008), 217–227.
Lafi, W.y Al-Qodad, Z. (2006). Combined
advanced oxidation and biological treatment
processes for the removal of pesticides
from aqueous solutions. Journal of Hazardous
Materials.137, (1), 489-497.
Lapertot, M., Ebrahimi, S., Dazio, S., Rubinelli,
A.y Pulgarín, C.(2006). Enhancing
biodegradability of priority substances
(pesticides) by solar photo-Fenton. Water
Research. 40, (1), 1086-1094.
Lambert, S.J., Thomas K.V. y Davy, A.J.
(2005). Assessment of the risk posed by
the antifouling booster biocides Irgarol
1051 and diuron to freshwater macrophytes.
Chemosphere. 63, (2006), 734–743.
Levenspiel, O. (1999). Chemical Reaction
Engineering, Third Edition. John Wiley &
Sons, New York.
Mayorga, H.F.y Izquierdo, A. (2008). Evaluación
de la toxicidad de efluentes provenientes
de la industria azucarera con contenido
de plaguicidas y su efecto en la aplicación
de un tratamiento fotocatalítico
biológico. I Congreso Latinoamericano
de Biotecnología Ambiental. Xalapa,
Veracruz, México.
Mc-Donald, L., Jebellie, S.J., Madramootoo,
C.A. y Dodds, G. (1999). Pesticide mobility
on a hillside soil in St. Lucia. Agriculture,
Ecosystems and Environment. 72, (2), 181-188.
Metcalf & Eddy, Inc. (1998). Ingeniería
de aguas residuales, Tercera Edición.
McGraw-Hill Interamericana, España.
Ministerio de Agricultura. (1984). Decreto
1594. Artículo 72. República
de Colombia.
Muñoz, I., Peral, J., Ayllon, J.,
Malato, S., Passarinho, P. y Domenech, X.
(2006). Life cycle assessment of a coupled
solar photocatalytic–biological process
for wastewater treatment .Water Research.
40, (19), 3533 – 3540.
Oller, l., Malato, S., Sánchez, P.,
Maldonado, M.A.y, Gassó, R. (2007).
Detoxification of wastewater containing
five common pesticides by solar AOPs–biological
coupled system Catalysis Today .129, (1-2),
69–78.
Parra, S., Sarria, V., Malato, S., Peringer,
P. y Pulgarín, C. (2000). Photochemical
versus coupled photochemical–biological
flow system for the treatment of two biorecalcitrant
herbicides:metobromuron and isoproturon.
Applied Catalysis, B: Environmental. 27,
(3), 153–168.
Pinillos, D.y Pinto, L. (2007). Estudio
de la Factibilidad de Biodegradación
de Efluentes Agroindustriales con Residuos
de Plaguicidas en una Industria Azucarera.
Trabajo de Grado, Universidad del Valle.
Romero, J. (2004). Tratamiento de Aguas
Residuales. Teoría y Principios de
Diseño. Ed. Escuela Colombiana de
Ingeniería. 551-593.
Sahinkaya, E. y Dilek, F. (2007). Effect
of feeding time on the performance of a
sequencing batch reactor treating a mixture
of 4-CP and 2,4-DCP. Journal of Environmental
Management. 83, (4), 427-436.
Sorensen, S.R., Bending, G.D., Jacobsen,
C.S., Walter, A. y Amand, J. (2003). Microbial
degradation of isoproturon and related phenylurea
herbicides in and below agricultural fields.
FEMS Microbiology Ecology. 45, (1), 1-11.
Vimazal, J. (2007). Removal of Nutrients
in Various Types of Constructed Wetlands.
Science of the Total Environment. 380, (1-3),
48 – 65.
Widehem, P., Ait-Aissaa, S., Tixierb, C.,
Sancelmeb, M., Veschambreb, H. y Truffaut,
N. (2002). Isolation, characterization and
diuron transformation capacities of a bacterial
strain Arthrobacter sp. N2. Chemosphere.
46, (4) ,527-534.
|
