| |
RESUMEN
La agroindustria de
extracción de almidón de yuca genera aguas residuales con
una alta carga orgánica que afecta los cuerpos receptores.
La tecnología anaerobia ha sido estudiada para tratar estas
aguas residuales obteniéndose resultados satisfactorios; sin
embargo, una de las principales limitantes del proceso ha sido la
elevada acidez del agua residual. En este estudio se presentan los
resultados de la evaluación de tres alcalinizantes comerciales:
cal hidratada - Ca(OH)2, hidróxido de sodio - NaOH y
bicarbonato de sodio - NaHCO3, empleados para neutralizar la acidez del
agua y garantizar capacidad buffer a costos accesibles para este sector
productivo. De los tres alcalinizantes evaluados, el que
presentó mejores resultados fue el bicarbonato de sodio seguido
del hidróxido de sodio.
PALABRAS
CLAVE
Alcalinidad Bicarbonática;
Bicarbonato de Sodio; Cal Hidratada; Capacidad buffer; Hidróxido
de Sodio
ABSTRACT
The
agro-industry of casaba
starch extraction produces wastewaters with high organic charge that
affects reception bodies. Anaerobic technology has been studied for the
treatment of these waste waters with good results. Nevertheless, one
the main constraints of the process has been waste water’s high
acidity. The present study shows the results of the evaluation of three
commercial alkalinizers: hydrated lime – Ca(OH)2, sodium hydroxide –
NaOH and sodium bicarbonate – NaHCO3, used to neutralize water and
assure buffer capacity at accessible costs for the productive sector.
From the three alkalinizers studied, the one with the best results was
sodium bicarbonate followed by the sodium hydroxide.
KEYWORDS
Bicarbonate alkalinity, sodium
bicarbonate, hydrated lime, buffer capacity, sodium hydroxide.
1.
INTRODUCCIÓN
En el departamento del Cauca se
concentra gran parte de la agroindustria rallandera del país; el
desarrollo de esta actividad conlleva un alto grado de
contaminación hídrica por la elevada carga
orgánica que aportan las aguas residuales generadas. De acuerdo
con Colin et al. (2007), se descargan diariamente 100 kg de DQO por
tonelada de yuca procesada a los cuerpos receptores y una
rallandería de nivel tecnológico medio, como las que
predominan en esta región, procesa entre 5 y 12,5 ton/semana
(CRC, 2005).
El agua residual del proceso de
extracción de almidón de yuca contiene carbohidratos
fácilmente hidrolizables que favorecen la fermentación
natural y, por consiguiente, la formación de ácidos
grasos volátiles- AGV, incidiendo en los bajos valores de pH,
prácticamente ausencia de alcalinidad y elevada acidez
(Pérez, 2007).
Existen diferentes estudios
realizados a escala de laboratorio y real para el tratamiento anaerobio
de estas aguas residuales; debido a su carácter ácido,
los reactores anaerobios evaluados han evidenciado la inestabilidad en
los sistemas a causa de la fácil acidificación del
agua residual y la ausencia de capacidad buffer, siendo fundamental el
ajuste de la alcalinidad y la corrección del pH mediante la
adición de acondicionadores químicos, denominados
alcalinizantes, que permitan generar capacidad buffer.
La eficiencia del proceso
está determinada por diferentes factores ambientales, entre los
cuales el pH y la alcalinidad son de gran relevancia. Las bacterias
metanogénicas tienen un crecimiento óptimo en un rango de
pH entre 6,6 y 7,6 unidades (Rittmann y Mc Carthy, 2001); sin embargo,
pueden conseguir estabilidad para la formación de metano en un
rango más amplio (6,0 - 8,0 unidades); valores menores a 6,0 y
superiores a 8,3 deben evitarse para prevenir la completa
inhibición de las bacterias metanogénicas (Chernicharo,
2007).
Existen varios productos que
pueden emplearse para proporcionar alcalinidad, los cuales pueden ser
diferenciados en dos grupos: los que reaccionan con el gas
carbónico para formar alcalinidad bicarbonática (Ej.
Ca(OH)2, NaOH, CaO,) y los que ofrecen alcalinidad bicarbonática
directamente (Ej. NaHCO3, NH4HCO3) (Chernicharo, 2007).
La cal hidratada (Ca(OH)2) es una
base fuerte comúnmente empleada por su bajo costo y facilidad de
adquisición, pero requiere de cuidado en la manipulación
debido a la insolubilidad de algunas sales que se forman generando
precipitados de CaCO3. La producción de bicarbonato se realiza
exclusivamente por la presencia del dióxido de carbono como lo
muestran las ecuaciones 1 y 2; estas reacciones químicas pueden
ocasionar vacío al interior del reactor por presiones negativas,
debido a la disminución de la presión del CO2 (Ritmann y
McCarthy, 2001); adicionalmente, cuando la presencia de CO2 en el medio
es insuficiente para reaccionar internamente con la cal puede ocasionar
que el pH final sea demasiado bajo o alto, perjudicando el proceso
anaerobio (Chernicharo, 1997).
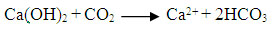 Ec. 1
Ec. 1
Al continuar con la
adición de cal se forma el carbonato de calcio insoluble, debido
al acentuado consumo de CO2 de los gases, como se observa en las
ecuaciones 2 y 3:
 Ec. 2
Ec. 2
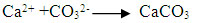 Ec.3
Ec.3
Este precipitado forma costras
duras en las paredes del reactor o en el medio de soporte para el caso
de reactores de película fija. Generalmente las reacciones
indeseables empiezan a producirse una vez el pH ha aumentado a 6,8
unidades (Ritmann y McCarthy, 2001).
El Hidróxido de sodio
(NaOH), es una base fuerte y no forma sales insolubles, neutralizando
eficientemente los ácidos fuertes, siendo, por lo tanto, una
solución más satisfactoria para el problema de la
neutralización; sin embargo, también disminuye la
presión de CO2 en el reactor, lo cual puede ocasionar una mezcla
explosiva de metano y oxígeno que conllevaría al colapso
estructural del reactor (Leslie, 1999; Chernicharo, 1997);
adicionalmente, una sobredosificación del producto
ocasionaría un incremento súbito del pH por tratarse de
una base fuerte, además de requerir de mayor cuidado durante su
manipulación (Souza, 1984).
Algunos factores adicionales que
se deben tener en cuenta al usar hidróxido de sodio es que da
una falsa idea de la capacidad buffer del sistema, ya que una vez
ingresen al sistema ácidos producto de las reacciones
microbiales, el pH descenderá rápidamente (Foresti y van
Haandel, 1998). El consumo de CO2 puede observarse en la
ecuación 4:
 Ec.4
Ec.4
El bicarbonato de sodio (NaHCO3)
es una sal formada por una base fuerte, hidróxido de sodio
(NaOH), y un ácido débil, ácido carbónico
(H2CO3), y, como todas las demás sales así formadas,
presentan características de sustancias buffer. El ion
bicarbonato sirve de buffer en valores del pH cercanos a 6,8 unidades
(Moraes et al., 2000). La ecuación 5 muestra la reacción
del bicarbonato (Field et al., 1995):
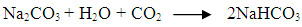 Ec. 5
Ec. 5
El bicarbonato de sodio es
fácil de manipular, bastante soluble y no reacciona con el CO2,
evitando problemas de presiones negativas en el sistema; además,
ejerce una excelente acción amortiguadora. Este compuesto es
considerado el principal suplemento de alcalinidad bicarbonática
y es el único producto que cambia suavemente el equilibrio del
medio para lograr un valor deseado, sin alterar el balance
fisicoquímico de la delicada comunidad biológica (Field
et al., 1995). Sin embargo, presenta como desventaja su mayor costo
frente al de la cal hidratada y el hidróxido de sodio.
La Figura 1 ilustra el
comportamiento de la presión del CO2 al interior de un reactor
anaerobio con la adición de bicarbonato de sodio y el uso de
productos con grupos hidróxidos ,talos como la cal hidratada y
el hidróxido de sodio. El cuadrado gris delimita las condiciones
adecuadas de operación en un proceso anaerobio.
En la figura se observa que para
la condición inicial del reactor, representada por el Punto 1
(40% CO2, 500 mgCaCO3/l y pH 6,3 unidades), si se adiciona bicarbonato
de sodio (NaHCO3) para incrementar la alcalinidad hasta 2100 mgCaCO3/l
(Punto 2), el pH se eleva a 6,9 unidades sin reducir la
concentración de CO2.
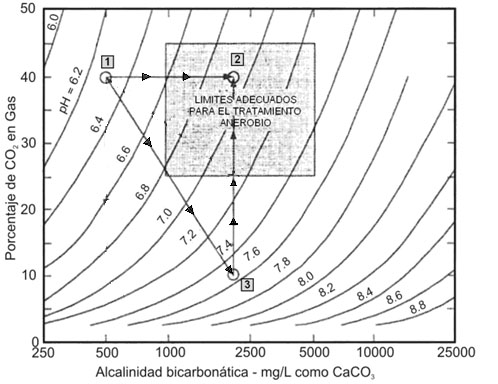
Figura
1. Efecto de la alcalinidad bicarbonática en la fase
líquida sobre el contenido de CO2 en la fase gaseosa
Por el contrario, si se
adicionara un producto con grupos hidróxidos, además de
incrementar la alcalinidad a 2100 mgCaCO3/L y elevar el pH a 7,5
unidades, ocurriría la disminución del contenido de CO2
por su consumo para producir bicarbonato (HCO3-) (Punto 3); la cantidad
de gas consumido dependerá del volumen en estado gaseoso y
líquido ocupado en el reactor. A manera de ejemplo, la figura
muestra una disminución de CO2 hasta un 10%; sin embargo, la
biomasa producirá nuevamente CO2 con el fin de equilibrar la
concentración inicial del gas hasta el 40%, ocasionando
nuevamente la disminución del pH de 7,5 unidades a 6,9 unidades
correspondiente al Punto 2.
Esta variación de pH puede
afectar la población metanogénica que se caracteriza por
su elevada sensibilidad frente a este factor ambiental.
En este estudio se
evaluaron tres alcalinizantes: cal hidratada (Ca(OH)2),
hidróxido de sodio (NaOH) y bicarbonato de sodio (NaHCO3) para
el acondicionamiento de la alcalinidad bicarbonática del agua
residual del proceso de extracción de almidón de yuca
procedente de una rallandería ubicada en el departamento del
Cauca, con el objetivo de mejorar la capacidad buffer durante el
tratamiento anaerobio.
2.
METODOLOGÍA
El estudio se dividió en
dos etapas: 1) Neutralización de acidez del agua residual y 2)
Ensayos de Actividad Metanogénica Específica – AME, para
determinar el rango de alcalinidad bicarbonática necesaria para
garantizar capacidad buffer.
El sustrato usado en el estudio
fue agua residual de una pequeña industria de extracción
de almidón de yuca, el cual fue caracterizado al inicio y al
final de cada ensayo con las variables mostradas en la Tabla 1.
Tabla 1. Caracterización
del sustrato al inicio y al final de cada ensayo
(1) (APHA et al.,
2005); (2) (Rypley et al., 1986)
2.1
Neutralización de la acidez
Se utilizaron como
acondicionadores químicos la cal hidratada (0,025N), el
hidróxido de sodio (0,05N) y el bicarbonato de sodio (2 g/L).
Considerando la variación de la calidad del agua residual en
términos de la acidez, se realizaron ensayos por duplicado con
los tres alcalinizantes y siete concentraciones de acidez
típicas en este tipo de agua residual (280 - 990 mgCaCO3/l).
En cada ensayo, a un volumen de
50 ml de agua residual se le midió el pH inicial, el cual fue
elevado con el respectivo alcalinizante hasta alcanzar un valor de 5,75
unidades, valor a partir del cual el alcalinizante ha reaccionado con
los Ácidos Grasos Volátiles –AGV y puede iniciarse el
suplemento de alcalinidad bicarbonática Chernicharo, 1997).
Una vez alcanzado el valor de
5,75 unidades, se registró el consumo del respectivo
alcalinizante y se monitoreó la variación del pH durante
aproximadamente 2,5 horas, con mediciones cada 20 minutos, para
verificar la permanencia de este valor en el tiempo.
2.2
Ensayos de actividad metanogénica específica – AME
Con los resultados obtenidos de
la etapa anterior, se realizaron montajes por duplicado de AME, usando
la técnica de desplazamiento de líquido (Field, 1987). La
Figura 2 muestra un esquema del montaje utilizado.
Los ensayos se realizaron en un
cuarto con temperatura controlada de 30±1ºC, usando como
sustrato agua residual del proceso de extracción de
almidón de yuca, y como inóculo un lodo granular
proveniente de un reactor UASB que trataba las aguas residuales de una
industria papelera de la región; el inóculo fue
caracterizado previamente con las variables mostradas en la Tabla 2
(APHA et al., 2005).
Figura 2. Equipos de desplazamiento de
líquido para determinación de la AME
Tabla 2.Tipo de medicion en el
inóculo para los ensayos AME
La cantidad de lodo adicionado se
determinó con base en la concentración recomendada de
2,5/L (Chernicharo, 2007) y el volumen de sustrato adicionado fue 300
ml, valor estimado de tal forma que la mezcla inóculo-
alcalinizante-sustrato no sobrepasara el 90% del volumen total de cada
reactor.
El objetivo de esta etapa del
estudio fue evaluar la influencia de la adición de alcalinidad
bicarbonática en la generación de capacidad buffer y el
desempeño en la digestión anaerobia.
Para ello, se emplearon muestras
de agua residual cuyo pH fue ajustado previamente hasta 5,75 unidades
con el respectivo alcalinizante y teniendo en cuenta las dosis
evaluadas en la etapa anterior; posteriormente se le adicionó al
sustrato neutralizado, alcalinidad bicarbonática (usando NaHCO3)
en seis concentraciones (500, 1000, 1500, 2000, 2500 y 3000
mgNaHCO3/l).
Una vez neutralizada el agua
residual y acondicionada con alcalinidad bicarbonática se
mezcló con el inóculo y dio inició a los ensayos
de AME.
3.
RESULTADOS Y DISCUSIÓN
3.1
Neutralización de la acidez
La Tabla 3 resume los resultados
obtenidos en los ensayos de neutralización de la acidez, en la
cual se detalla el pH del agua cruda y el consumo de alcalinizante para
los diferentes valores de acidez del agua residual evaluados.
Se observa que la cal hidratada y
el hidróxido de sodio presentan un consumo menor con
relación al dicarbonato de sodio debido a que los dos primeros
son bases fuertes que aportan directamente grupos hidroxilos OH-
elevando el pH rápidamente, a diferencia del bicarbonato de
sodio que es una sal que eleva suavemente el pH. La Figura 2 muestra la
variación del pH en el tiempo para los tres alcalinizantes
evaluados.
Tabla 3. Consumo de alcalinizante durante
el acondicionamiento del pH a 5,75 unidades.
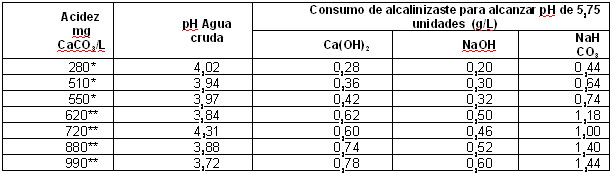
* Valores presentados cuando se
empleó agua residual fresca o con máximo 8 días de
almacenamiento
**
Valores presentados cuando se empleó agua residual entre 8 y 23
días de almacenamiento o la yuca procesada no era fresca.
Se observa que el pH de 5,75
unidades disminuye en el tiempo cuando se neutraliza la acidez
con cal hidratada o hidróxido de sodio indicando que no
garantizan suficiente capacidad buffer para lograr la
neutralización de todos los ácidos grasos formados, a
diferencia del bicarbonato de sodio, el único de los tres
productos evaluados que garantiza esta condición; esto ratifica
lo encontrado por Field et al., (1995), quienes afirman que el
bicarbonato de sodio es el único producto que suavemente cambia
el equilibrio para lograr un valor deseado, garantizando condiciones
estables a los microorganimos, siendo el principal suplemento de
alcalinidad bicarbonática.
Figura 3. Curvas de variación del
pH en el tiempo
3.2
Ensayos de actividad metanogénica específica –AME
Las
características del agua residual empleada para los ensayos AME
se muestran en la Tabla 4.
Tabla 4. Características del agua
residual empleada para el ensayo AME
El carácter ácido
del agua residual se evidencia en el bajo valor de pH,
prácticamente ausencia de alcalinidad bicarbonática y
elevada acidez, lo cual ratifica la necesidad de su acondicionamiento
para el proceso anaerobio. El elevado contenido de materia
orgánica se refleja en los valores de la DQO total y filtrada y
se observa que los sólidos se encuentran principalmente en forma
disuelta.
Las características del
inóculo usado para los ensayos AME se muestran en la
Tabla 5.
Tabla 5. Características del
inóculo
La relación STV/ST se encuentra
dentro del rango común para lodos granulares (0,45 – 0,90)
(Hulshoff Pol, 1989),además de indicar de forma indirecta que el
inóculo presentaba una adecuada proporción de biomasa
activa (Von Sperling, 1996).
Los resultados obtenidos en los ensayos
AME se resumen en la Figura 4.
Se observa que a pesar de que el rango
de variación de la alcalinidad bicarbonática adicionada (
500-3000 mgNaHCO3/l) fue el mismo para los ensayos con los tres
alcalinizantes usados inicialmente para neutralizar la acidez (ajuste
pH a 5,75), hubo diferencias en los valores de AME en función
del tipo de alcalinizante usado.
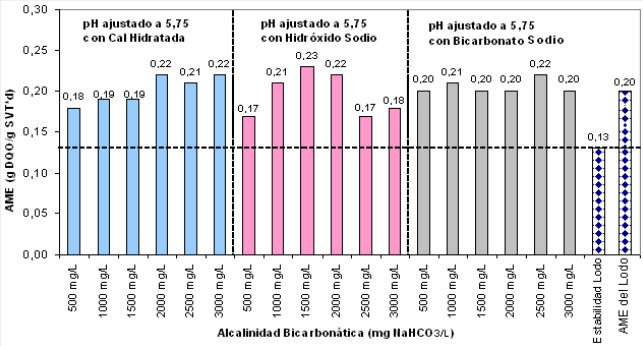
Figura 4. Ensayos de Actividad
Metanogénica
En los ensayos en que se usó la
cal hidratada se observó un ligero incremento en el valor de AME
a partir de 2000 mg/l de alcalinidad bicarbonática. El
hidróxido de sodio, aunque presentó el mayor valor de AME
de todos los ensayos, con una dosis de 1500 mg/l, muestra
también una disminución para concentraciones superiores a
este valor, lo que indica probablemente un efecto inhibitorio.
En cuanto al bicarbonato de sodio se
observa un comportamiento relativamente estable, indicando que
cualquier concentración podría ser apropiada para el
desarrollo del proceso anaerobio sin existir inconvenientes de
inhibición por sobredosificación; los valores de AME
obtenidos para las dosis más altas ratifican lo mencionado por
Rittmann y McCarty (2001), quienes afirman que dosis de bicarbonato de
sodio superiores a 5000 mg/l no ocasionan ningún efecto positivo
adicional o adverso al proceso anaerobio, sin embargo, repercute en
costos de tratamiento.
En general, todas las combinaciones de
alcalinizantes evaluadas presentaron valores superiores a la
estabilidad del lodo, indicando que el proceso anaerobio
presentó un desempeño adecuado, lo que permite confirmar
que el acondicionamiento químico del agua residual favorece el
proceso. Teniendo en cuenta el valor de AME inicial del lodo (0,20
gDQO/gSVT.d) y los valores de AME obtenidos para los tres
alcalinizantes, los rangos de alcalinidad bicarbonática
apropiados para garantizar capacidad buffer están
entre 2000 y 3000 mg/l para Ca(OH)2, entre 1000 y 2000 mg/l para NaOH y
entre 500 y 3000 mg/l para NaHCO3.
La Tabla 3 muestra una
comparación económica teniendo en cuenta el consumo de
los tres alcalinizantes para la neutralización del pH a 5,75
unidades y el consumo de bicarbonato de sodio para garantizar capacidad
buffer, cuya dosis se definió a partir del mínimo consumo
que aseguró un valor de AME igual o superior a 20gDQO/gSVT.d),
siendo estos valores: 2000 mg/l para Ca(OH)2, 1000mg/l para NaOH y
500mg/l para NaHCO3.
La cal hidratada, aunque presenta el
menor costo para la neutralización de la acidez ($320/m3),
requiere de un mayor aporte de bicarbonato de sodio para garantizar
capacidad buffer al proceso, lo que al final eleva el costo total de
acondicionamiento del agua con relación a los otros dos
alcalinizantes ($1520/m3). El costo total para el hidróxido de
sodio ($1080/m3) es similar al obtenido con el bicarbonato de sodio
($1160/m3). Teniendo en cuenta las ventajas del bicarbonato de sodio
(alta solubilidad, fácil de manipular y evitar problemas de
vacío en el sistema) se recomienda el uso del bicarbonato de
sodio, tanto para neutralizar la acidez como para garantizar capacidad
buffer.
Tabla
6 Costo requerido para neutralización de acidez y
garantizar capacidad buffer
4. CONCLUSIONES
.
Debido al carácter ácido del agua residual del proceso de
extracción de almidón de yuca es fundamental su ajuste
con acondicionadores químicos que garanticen condiciones
ambientales adecuadas para el desempeño del proceso anaerobio.
. Los resultados
obtenidos indican la potencialidad del uso de bicarbonato de sodio
tanto para neutralizar la acidez como para garantizar capacidad buffer
durante el tratamiento anaerobio, a diferencia del hidróxido de
sodio el cual, aunque resulta un poco más económico,
puede llegar a causar problemas de vacío en el sistema de
tratamiento y riesgos por sobredosificación y
manipulación.
. La cal hidratada,
aunque mostró ser más económica en la
neutralización de la acidez, requirió un mayor aporte de
bicarbonato de sodio para garantizar capacidad buffer, lo
incrementa el costo total de acondicionamiento de la alcalinidad del
agua y la convierte en un solución más costosa,
además de causar problemas por la formación de
insolubles, riesgos por sobredosificación y vacío en el
sistema.
. La acidez del agua
residual varía en el proceso de extracción de
almidón de yuca, siendo necesario determinar experimentalmente
la dosis de alcalinizante requerida para ajustar el pH hasta un valor
de 5,75 unidades para neutralizarla; adicionalmente, debe garantizarse
capacidad buffer mediante la adición de un suplemento de
alcalinidad bicarbonática con una dosis de al menos 500 mg/l de
bicarbonato de sodio.
5. REFERENCIAS
BIBLIOGRÁFICAS
APHA,
AWWA y WPCF (2005). Standard Methods for the examination of water and
wastewater.
Colin, X., Farinet, J.L., Rojas, O. y
Alazard, D. (2007). Anaerobic treatment of cassava starch
extractionwastewater using a horizontal flow filter with bamboo as
support, J. Bioresource Technology, 98(8), 1602-1607.
CRC. (2005). Rallandero Limpio. Cartilla
informativa y educativa.
Popayán, Colombia. Corporación Regional del Cauca.
Chernicharo, C. A. (2007). Principios do
tratamento biológico de
águas residuárias. Reactores anaeróbios, Vol V.
Universidade Federal de Minas Gerais. Departamento de Engenharia
Sanitária e Ambiental. Brasil.
Field, J. (1987). Parámetros
operativos del manto de lodos
anaeróbicos de flujo ascendente. En: Manual de arranque y
operación de sistemas de flujo ascendente con manto de lodos –
UASB. Universidad del Valle, Corporación Autónoma
Regional del Cauca, Universidad Agrícola de Wageningen.
Field J, Sierra R., Alvarez, Lettinga,
G. (1995). Effect Wastewater
characteristics and environmental factors. En: Curso
internacional de tratamiento anaerobio de aguas residuales. Universidad
de Wageningen.
Foresti, E. y Van Haandel, A. (1998).
Fundamentos do Tratamento
Anaeróbio. En: Tratamento de Esgotos Sanitários por
Processo Anaeróbio e disposição controlada no
solo. PROSAB, Brasil.
Hulshoff Pol, L.(1989). The phenomenon
of granulation of anaerobic
sludge. Doctoral Thesis, Wageningen Agricultural University.
Wageningen - Netherlands.
Leslie, C.P., Daigger, G.T. y Lim, H.C.
(1996). Biological wastewater treatment. 2ª ed. U.S.A, New York.
Parkin, G.F. y Owen, W.F. (1986).
Fundamentals of anaerobic
digestión of wastewater sludges. Journal of the environmental
engineering division, ASCE 112:867-920.
Pérez, A. (2007).
Optimización de un filtro
anaerobio en escala real para el tratamiento de aguas residuales del
proceso de extracción de almidón de yuca. Tesis
Maestría. Cali, Colombia: Universidad del Valle, Posgrado en
Ingeniería Sanitaria y Ambiental.
Rittman, B. y McCarty, P. (2001).
Biotecnología del medio ambiente Principios y aplicaciones.
McGraw Hill, España.
Souza, M.E. (1984). Fatores que
influenciam a digestão anaeróbia. Revista DAE, v. 44, p.
88-94.
Von Sperling, M. (1996). Principios
basicos do tratamento de esgotos.
Departamento de Engenharia Sanitaria e Ambiental. Universidade Federal
de Minas Gerais. Brasil.
 |
Mayor
información |
Facultad
de
Ingeniería - Escuela de Ingeniería de los Recursos
Naturales y del Ambiente EIDENAR
c.e.: eidenar@univalle.edu.co
Telefax: +57 2 3212153 - +57 2 3212159
Edificio 344 - Ciudadela Universitaria Meléndez
Universidad del Valle
Cali, Colombia
©2009 - Universidad del Valle -Luis Eduardo González
Muñeton
|
|
|
|
|