| |
RESUMEN
Los hongos P. ostreatus, presentan pardeamiento
enzimático en el periodo de poscosecha,
para minimizarlo se incorpora
ácido ascórbico como inhibidor
de la polifenol oxidasa. Un método
de conservación de los hongos es
la inmersión en salmueras, aumentando
así el periodo de vida útil.
El objetivo de este trabajo fue determinar
las condiciones óptimas para la cosecha
del hongo, la selección de un método
de conservación por impregnación
en salmuera a presión atmosférica
y a vacío.
Los
resultados mostraron que el momento óptimo
de cosecha fue el quinto día de la
aparición del primordio, con una
composición fisicoquímica
de 0,998±0,001 actividad de agua
(aw), 93,027%±0,582 humedad (xw),
textura 1,3±0,15 Kgf y color DE 57,830±0,842
y
61,711±1,156,
en la cara lisa y la cara rugosa respectivamente.
La mejor respuesta de conservación
se alcanzó con el hongo impregnado
en salmuera al 1,5% de NaCl y Sacarosa,
con pulso de vacío, con una
composición fisicoquímica
de 0,996±0,001 aw y 91,760±0,643
xw. La incorporación de ácido
ascórbico fue del 50% de la Ingesta
Diaria Recomendada, a partir de la
fracción volumétrica y la
densidad del hongo, lo cual mejoró
el color.
Palabras clave
Pleurotus ostreatus, pardeamiento, salmuera,
textura, impregnación
ABSTRACT
Fungi
P. ostreatus, present enzymatic browning
in the postharvest period, to minimize it
includes ascorbic acid that inhibitor of
polyphenol oxidase. To method of preservation
of mushrooms is immersed in brine, thus
increasing the life span.
The aim of this study was to determine the
optimal conditions for the harvest of the
fungus, the selection of method of preservation
by impregnation in brine AT atmospheric
pressure and vacuum. The results showed
that the harvest Time is the fifth day the
emergence of the primordium, a physical
and chemical composition of 0.998±0.001
water activity (aw), 93,027 ± 0,582%
moisture (xw), 1.3±0.15 Kgf texture
and color DE 57.830±0.842 and
61.711±1.156 in the smooth
surface and the rough surface respectively.
The best response was reached with the preserving
of mushroom in brine solution impregnated
in 1,5% NaCl and sucrose with vacuum pressure,
chemical and physical composition was 0.996±0.001
aw, 91,760 ± 0,643 xw, the ascorbic
acid was incorporated with 50% since volumetric
fraction and mushroom’s density, so
the color is best.
Keywords
Pleurotus ostreatus, browning, brine, texture,
impregnation.
1. INTRODUCCION
Los
hongos macroscópicos de cuerpo arbóreo
se han considerado setas, entre estos se
encuentra el hongo P. ostreatus el
cual comprende cerca de 40 especies (A.O.A.G
colak, 2007et al.), son valiosos por su
alto contenido de proteína (A.O.A.G
colak, 2007, Colak , 2007). Los hongos
se consumen frescos o procesados, principalmente
en salmuera, impregnados y deshidratados
entre otros tratamientos (Cortes, 2007;
Giri; 2007).
Los hongos durante la poscosecha,
se comportan como las demás hortalizas
y al carecer de película protectora
son vulnerables a cambios físicos,
microbianos y daños mecánicos;
la pérdida de turgencia y procesos
de degradación afectan la vida media
durante el almacenamiento (Gowen, 2006,
Jakumar, 2006) lo cual altera su textura
y color, parámetros de gran importancia
en la industria de los hongos (Ggarcia W.C.L.,
2006;Jolivet S, 1998; Kotwalwale , 2007).
La textura de los hongos, está definida
por la disposición del tejido
reticulado la cual produce un material
blando con una energía paralela a
las fibras reticuladas del mismo (Maillard
M, C.2007 .et al.) en cuanto al color,
el pardeamiento enzimático
tiene lugar durante la senescencia o daño
en la post cosecha, este ha sido atribuido
a la actividad de la Polifenol Oxidasa
(1,2-benzenodioloxigen oxido reductasa;
EC1.1.10.3.1), (PPO) (Jolivert S., 1998,
et.al) y la velocidad de dicho proceso está
determinada por la concentración
de la enzima, compuestos fenólicos,
pH, temperatura, oxigeno disponible
y actividad de agua (Cortes M., 2007,
.et al.). Para evitar el pardeamiento se
utiliza el ácido ascórbico
(Vit C) (Jolivert S., 1998, et.al.).
La salazón se ha utilizado
desde la antigüedad para la conservación
de alimentos, el intercambio entre la sal
del exterior y el agua en el interior de
la célula induce la deshidratación;
modalidades de este tratamiento son la deshidratación
en pila de sal y la inmersión en
salmuera, el transporte de NaCl se
realiza por difusión. El tratamiento
osmótico requiere baja consumo de
energía; se basa en colocar un alimento
en solución para que se realice un
intercambio de solutos con la solución
a presión atmosférica (Martinez
M.Torreggianib, 2004 ,et.al)
Para incrementar el intercambio de materiales
y la cinética de transferencia se
ha implementado la impregnación
a presión reducida o a vacío
(IV), esta técnica contribuye
a la conservación del color, sabor
y aroma del alimento fresco (Garcia W.,
2007 , et al.). En la impregnación
a vacío de los alimentos hay sustitución
parcial de la fase gaseosa, por la solución
de impregnación; la incorporación
de solutos depende de su porosidad efectiva
y las propiedades mecánicas (Martinez
M.V.,1995 , .et.al ). La impregnación
a presión atmosférica y a
vacío se aplica con el objetivo de
modificar la composición del alimento
con la remoción parcial de
agua y la impregnación de solutos,
sin afectar su integridad estructural (Murugesan
et al., 1995)
La impregnación, también se
emplea como pretratamiento en el secado;
cuando se utiliza aire caliente se modifican
las propiedades del material, la temperatura
causa cambios químicos, físicos
y biológicos en el alimento (Cortes,
2007, Martinez, 1995, y Rodriguez, 2001,
Toivine et al., 2008), la evaporación
de agua concentra los sólidos solubles
de la matriz; el secado con microondas minimiza
la deformación del alimento y permite
una deshidratación homogénea
(Sacchetti et al., 2001). Los hongos deshidratados
por sistema combinado de aire caliente microondas,
proporcionan cualidades satisfactorias para
la rehidratación y retención
de aromas (Sacchetti et al., 2001;Toivone.,
2008).
El objetivo de este trabajo fue determinar
las condiciones óptimas para la cosecha
del hongo P. ostreatus, y la selección
de un método de conservación
por impregnación en salmuera a presión
atmosférica y a vacío
2. MATERIALES Y MÉTODOS
Materia
prima
Se utilizaron hongos P. ostreatus cultivados
en la ciudad Armenia producidos en
sustrato de vainas de arveja, la cinética
de cosechad se dio en un periodo de cinco
(5) días continuos a partir del tercer
día de la aparición del primordio,
se conservaron en papel parafinado y
refrigeraron a 8ºC en el Laboratorio
de Diseño de Nuevos Productos
de la Universidad del Quindío.
Soluciones de impregnación
Se prepararon 3 soluciones, teniendo en
cuenta la aw del hongo (0,998±0,001),
en composiciones del 1,5% de concentración;
la primera (2:1) con 1% NaCl: 0,5% sacarosa,
la otra (1:1) con 0,75% de NaCl y
0,75% sacarosa, la tercera solución
(1:2) con 0,5% de NaCl y 1% sacarosa.
Impregnación
Las muestras de hongo se cortaron
en geometrías de 1 cm2, se pesaron
en fresco y se impregnaron en soluciones
de salmuera al 1,5% (en las diferentes composiciones)
una proporción de 1:10 (gramos de
hongos: mL de solución) a presión
atmosférica de 863,289 mb y a vacío
de 677,277 mb.
Fortificación
La fortificación del hongo fresco
con Vitamina C, se definió en un
50% de IDR (30 mg de ácido ascórbico/100g
de hongo fresco). Se calculó la fracción
volumétrica se siguió el protocolo
No. P-012, de la Universidad
Nacional de Colombia Sede Medellín.
La densidad aparente del hongo 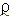 (apm)será
determinó a partir de la relación
de la masa de la muestra y el volumen
desplazado por la muestra en una probeta,
y la densidad de la disolución
de impregnación (apm)será
determinó a partir de la relación
de la masa de la muestra y el volumen
desplazado por la muestra en una probeta,
y la densidad de la disolución
de impregnación 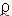 (dis)
se determinará por el método
del picnómetro, siguiendo el método
oficial 945.06 (AOAC,1990) [26]. (dis)
se determinará por el método
del picnómetro, siguiendo el método
oficial 945.06 (AOAC,1990) [26].
Las ecuaciones 1 y 2 permiten calcular la
fracción másica para cualquier
Componente Fisiológicamente Activo
(CFA), (YCFA)
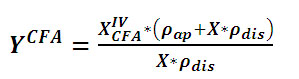 (1) (1)
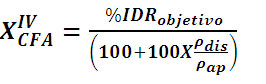 (2)
(2)
Donde:
X es la fracción volumétrica
de impregnación (m3dis / m3hongo
fresco),
XIVCFA (KgCFA/Kg
hongo impregnado)
es la fracción másica del
CFA en el hongo impregnado
%IDR el porcentaje de Ingesta Diaria Recomendada
(IDR)
rap
es la densidad aparente (Kg/m3)
rdis
es la densidad de la disolución (Kg/m3)
La densidad real se determinó según
la ecuación 3
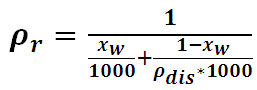 (3)
(3)
Donde:
rr es la densidad real
Xw
es la humedad expresada como
fracción molar
La porosidad se determinó según
la ecuación 4.
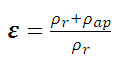 (4) (4)
Donde:
rr es la densidad
real (Kg/m3)
rap es la densidad
aparente (Kg/m3)
Caracterización fisicoquímica
Los hongos frescos y procesados se caracterizaron
por triplicado, los parámetros analizados
fueron: actividad de agua (aw) empleando
un higrómetro de punto de rocío
Aqua Lab series 3 TE con 0,001 de sensibilidad
y un rango de temperatura de 20 a 25°C;
humedad método AOAC 20013 en
estufa de vacio a temperatura de 60°C
(NAPCO Vacum oven model 5831 P selecta vacio
Tem-T). Humedad (xw); sólidos
solubles con un refractómetro THERMO
modelo 334610, siguiendo el método
AOAC 932,12 [26].
La
acidez titulable por el método volumétrico,
expresado como porcentaje de ácido
málico. El pH por el método
potenciométrico, con un pH metro
HANNA N° 212 con electrodo de
vidrio. La proteína se determinó
según el protocolo del método
Kjeldahl, para la determinación de
proteínas en hongos (60min a 370ºC
y 20 min a 420ºC) en un equipo velp
Scientifica VOK.
La textura se utilizó un texturometro
TA.XT. Plus Texture (con un software TEE
32 EXP, con una pinza VOLODKEVICH a una
velocidad de penetración de 10mm/s.
El color se determinó en un colorímetro
CiE Lab Minolta modelo CR-10.
Análisis Estadístico
Los datos se analizaron utilizando las mínimas
diferencias significativas (LSD), con un
nivel de confianza del 95% (=0,05). El análisis
de varianza se realizó con
el programa estadístico STATGRAPHICS
Centurión XV.II.
3.
RESULTADOS Y DISCUSIÓN
Caracterización
del hongo fresco
En la figura 1, se observa la
relación entre la actividad
de agua (aw) y la humedad (xw), del hongo
P.ostreatus durante el periodo de
cosecha (días 3, 4, 5, 6 y 7) y la
variación del color como DE
a
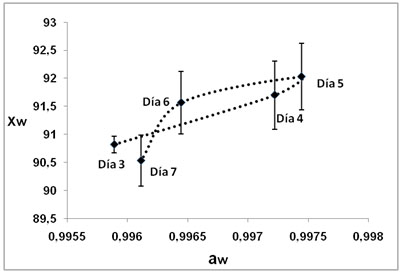
b
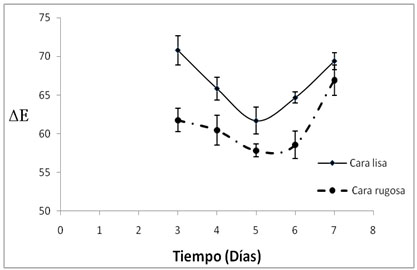
Figura
1. aw y xw, del hongo P. ostreatus, durante
el periodo de cosecha en los días
3, 4, 5, 6 y 7 (a) y Variación del
color DE (b)
El comportamiento de la aw y la xw en los
días evaluados para la cosecha del
hongo, muestran la incorporación
de agua al cuerpo fructífero en el
proceso de desarrollo, siendo el 5º
día el que presenta mayores valores
para estos parámetros 0,998±0,001
aw y 92,027%±0,591 xw, lo que indica
la mayor acumulación de humedad,
permitiéndole mantener sus características
de frescura. La variación del color
(DE), está asociado al contenido
de humedad siendo menor el valor de DE para
el quinto día; sin embargo hay variación
en este parámetro para las dos caras,
en la cara rugosa fue (61,711±1,156)
posiblemente debido a la disposición
de las lamelas lo cual disminuyen la reflexión
de la luz, mientras que la parte lisa presenta
menores valores (57,830±0,842). En
el día 7 hay una variación
significativa del color para las dos caras
del cuerpo fructífero, este fenómeno
puede estar asociado al incremento de a*
y b* ya que se evidencia el pardeamiento
propio del daño mecánico,
la acción enzimática, microbiana
y la senescencia.
Chang and Miller, 1999 y Cardona,
2001), explican la importancia de la humedad
en el desarrollo de las setas, tanto
en el sustrato como la atmósfera,
encontrándose esta entre 80%
y 85% en el cuarto de fructificación
y de 50% a 75% para el sustrato. Martínez
y Wong , 2009) ,reportó que el pardeamiento
en los días 6 y 7 de cosecha está
asociado a la senescencia.
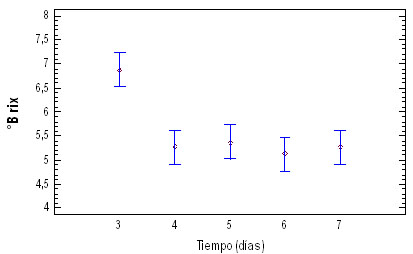
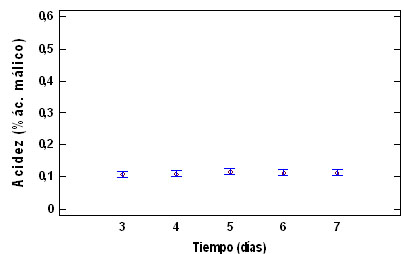
En la figura 2, se muestra la relación
de los ºbrix, acidez y pH del
hongo Pleurotus ostreatus spp., durante
el periodo de cosecha (días 3, 4,
5, 6 y 7)
a
b
c
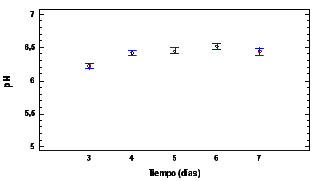
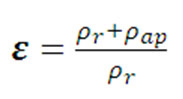
Figura 2. ºBrix, acidez y
pH del hongo P. ostreatus, durante
el periodo de cosecha evaluado
Los valores de ºbrix, acidez y pH presentan
diferencias significativas entre el tercer
día de la aparición del primordio
y los restantes días evaluados; esto
explica que posiblemente en el tercer día
primordio se encuentra en un estado de desarrollo
que permite que a partir de la absorción
de agua y otros nutrientes del sustrato,
desarrolla completamente el cuerpo fructífero.
El análisis fisicoquímico
para el día 5, posterior a la
aparición del primordio fue: ºbrix
5,557 ± 0,251, acidez 0,1103 ±
0,014 y pH 6,231 ± 0,111. Valores
similares fueron reportados por (Ruiz et
al., 2010) en hongos Pleurotus ostreatus;
(Rodríguez y Gómez ,
2001) reporta que el desarrollo del cuerpo
fructífero está entre el 3º
y 5º días para el mismo hongo.
Relacionando los resultados obtenidos para
la actividad de agua y la humedad con los
ºbrix, acidez y pH, se considera que
en el día 5º el hongo P. ostreatus
ha alcanzado la madurez fisiológica,
ya que después de este momento se
inicia la disminución en el contenido
de humedad favoreciendo el pardeamiento
y los daños estructurales del cuerpo
fructífero.
Textura
En la figura 3, se muestra la relación
Fuerza /Día (F/D) para corte del
cuerpo fructífero del hongo
Pleurotus ostreatus, durante el periodo
de cosecha (días 3, 4, 5, 6 y 7)
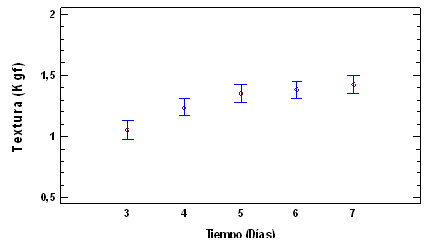
Figura 3. Fuerza/Día, del
hongo P. ostreatus, durante los el periodo
de cosecha evaluado
Los
valores de la relación Fuerza/Día
para el cuerpo fructífero en los
diferentes tiempos de muestreo, evidencian
el incremento de la fuerza en el corte ,
esto se debe posiblemente al endurecimiento
de la estructura por la deshidratación
del tejido, la cual se observa en la disminución
de la xw y la aw, La relación Fuerza
/Día presentó diferencias
significativas entre el día 3º
y el 7º, corroborando lo reportado
por (Rodríguez y Gómez, 2001)
en cuanto al proceso de desarrollo del cuerpo
fructífero de estos hongos.
Tratamientos de impregnación
En la figura.4, se presentan los parámetros
de aw y xw evaluados en las
diferentes formulaciones realizadas para
las soluciones al 1,5% de NaCl-Sac, relación
2:1 (1); 1:1 (2); 1:2 (3), impregnado a
presión atmosférica
(IPA), e impregnado al vació (IV)
en el 5 día de aparición del
primordio del hongo Pleurotus ostreatus
en comparación con la muestra sin
impregnar.
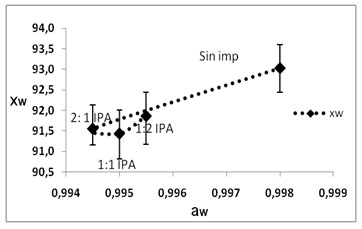
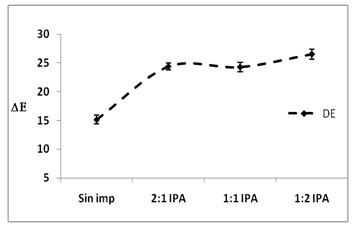
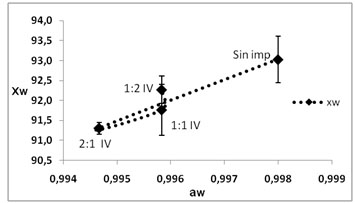
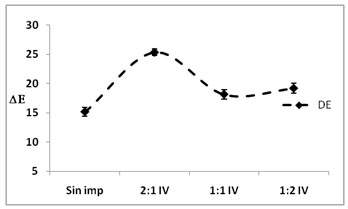
Figura
4. Evaluación de aw ,
xw y color (?E) en las diferentes
formulaciones para solución 1,5%
NaCl-Sacarosa
Los mínimos valores en el contenido
de agua expresada como aw
y xw se en
los diferentes tratamientos, fue 91,760±0,643
xw y 0,995±0,001
aw en la solución 1:1
IPA y 91,302±0,145 xw
y 0,995±0,001 aw en la solución
2:1 IV. En la IV, los valores mínimos
para la xw se presentan
cuando la concentración de NaCl es
mayor; la concentración de electrolitos
afecta directamente la xw, mientras que
la aw no varía.
Al relacionar las gráficas
xw- aw
con las gráficas de DE, en
la IPA no hay variación del color
al modificar las formulaciones de la solución,
mientras que en la IV la variación
del color se incrementa cuando la concentración
de NaCl es mayor. Valores similares fueron
reportados por (Ruiz et al., 2010),
en proceso de impregnación de hongos
Pleurotus ostreatus.
La formulación 2:1 modifica sensiblemente
el color, siendo este un factor negativo,
es posible modificar este aspecto
con la adición de un antipardeante
como el ácido ascórbico (vitamina
C); la formulación 1:1 presenta
una respuesta próxima a la del hongo
sin impregnar.
En la figura 5, se relaciona el pH
y la acidez evaluados
en las diferentes formulaciones realizadas
para las soluciones al 1,5% NaCl:Sac, relación
2:1 (1); 1:1 (2); 1:2 (3), impregnado a
presión atmosférica
(IPA), e impregnado al vació (IV)
en el 5 día de aparición del
primordio del hongo P. ostreatus, en comparación
con la muestra sin impregnar.
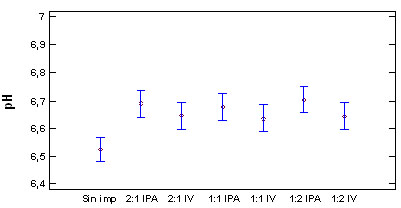
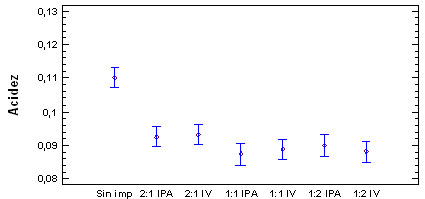
Figura 5. Evaluación del pH
y acidez en las diferentes formulaciones
para solución 1,5% NaCl-Sacarosa
El pH y la acidez
se modificaron significativamente en relación
al hongo sin impregnar, por la retención
de solución de impregnación
en la estructura del hongo, intercambiando
material con esta, disminuyendo la concentración
de los compuestos que determinan la acidez
en el interior de las células.
En la figura 6, se presenta la tendencia
del ºbrix y % Cloruros al impregnar
los hongos, en las soluciones en las formulaciones
para solución 1,5% NaCl:Sac, relación
2:1 (1); 1:1 (2); 1:2 (3), impregnado a
presión atmosférica
(IPA), e impregnado al vació (IV)
en el 5 día de aparición del
primordio del hongo Pleurotus ostreatus,
en comparación con la muestra sin
impregnar.
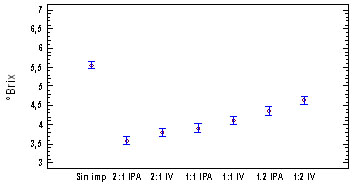
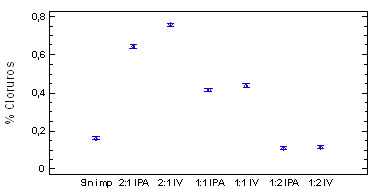
Figura 6. Evaluación de los ºbrix
y % de cloruros en las diferentes
formulaciones para solución 1,5%
NaCl-Sacarosa
El comportamiento de los ºbrix, Fig.
6-a muestran una disminución significativa
respecto al hongo sin impregnar, posiblemente
debido a la solubilización de algunos
componentes a causa de la retención
de solución por el hongo, sin embargo
hay un incremento al aumentar la concentración
de sacarosa en la formulación de
la salmuera, por lo que se avaluó
en forma independiente la concentración
de cloruros, la Fig. 6-b muestra el incremento
en la salinidad, proporcionalmente a la
concentración de NaCl en la salmuera;
El sistema se modificó por a aplicación
de vacío. Posiblemente porque la
impregnación a vació (IV)
incrementa la transferencia de masa, ganancia
de solutos [8,18, 20].
En la figura 7, se compara la textura
para las diferentes formulaciones
realizadas para las soluciones al 1,5% NaCl:Sac,
relación 2:1 (1); 1:1 (2);
1:2 (3), impregnado a presión atmosférica
(IPA), e impregnado al vació (IV)
en el 5 día de aparición del
primordio del hongo Pleurotus ostreatus
en comparación con la muestra sin
impregnar.
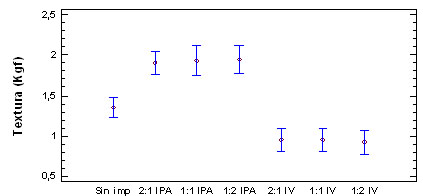
Figura
7. Evaluación de la textura en
las diferentes formulaciones para solución
1,5% NaCl-Sacarosa
La textura
se afecta por acción del tratamiento
de impregnación y no por la composición
de la solución, la IPA incrementa
la textura, posiblemente por la cantidad
de solución atrapada en las lamelas,
la cual actúa como un muelle, mientras
que en la IV, los cambios de presión
pueden fracturar la estructura, debido a
la composición de la pared celular
(polisacáridos-quitina), disminuyendo
la fuerza de corte, aspecto que favorece
la condiciones del alimento.
En la pared celular fungal, se ha encontrado
glucosa usualmente en forma de glucanes,
celulosa b(1-4), a(1-4) y glicógeno
a (1-6), glucan de levadura b(1-3) y b (1-6)
constituye entre 80 y 90% de la materia
de la pared celular de muchas especies,
y la glucosamina (en quitina), entre 1 y
58% (por lo general 5-20%) [1].
Teniendo en cuenta la respuesta al proceso
de impregnación a presión
atmosférica y a vació, la
solución que se seleccionó
con el propósito de conservar el
sabor sal asociado a los hongos comestibles
fueron las formulaciones 1:1 y la 2:1 (1%
NaCl: 0,5%Sacarosa) está con adición
de ácido ascórbico (Vitamina
C).
4. CONCLUSIONES
·
El hongo P. ostreatus, cosechado al
quinto día de aparición del
primordio presenta características
fisicoquímicas como 0,998±0,001
actividad de agua (aw), 93,027%±1,156
humedad (xw), 5,557±0,251 ºbrix,
0,1103%±0,014 acidez, 6,231±0,111
pH, 21,26%±0,85 porcentaje
de proteína en base seca (bs), color
DE 61,711±1,56 y 57,830±0,842,
en la cara lisa y la cara rugosa respectivamente,
textura 1,35±0,27 Kgf, que determinan
el tiempo de cosecha.
·
La mayor eficiencia para la incorporación
de solutos, efectos positivos en la textura
de estructuras porosas como el hongo
P. ostreatus es el proceso de impregnación
asistido con vacio
·
Las formulaciones de salmuera al 1,5% NaCl:Sacarosa,
seleccionadas para el proceso de conservación
del hongo Pleurotus ostreatus fueron 1:1
por su efecto en el color y 2:1 por el contenido
de NaCl, la cual debe ser enriquecida con
ácido ascórbico.
5.
REFERENCIAS BIBLIOGRÁFIA
A.O.A.C.
(1990). “Official methods of Analysis”.
Association of official Analytical Chemists.
Washington D.C; USA
Cardona L.F. (2001) Anotaciones acerca
de la bromatología y cultivo del
hongo comestible Pleurotus ostreatus.
Cronica Forestal y medio ambiente. No.
1
Chang S.T.; Miles P.G. (1999) Biología
de las setas. World Scientific. Agora
Editores Ltda. Santa Fe de Bogotá,
D.C. Colombia. 1°Edición en
Español. Pág. 20, 22, 48
y 66.
Colak A.; Sahin E.;Yildirim M.; Sesli
E. (2007) Polyphenol oxidase potentials
of three wild mushroom species harvested
from Liser High Plateau, Trabzon. Food
Chemistry. vol. 103 1426–1433
Colak A.; Sahin E.; Yildirim M.; Sesli
E. (2007) Polyphenol oxidase potentials
of three wild mushroom species harvested
from Liser High Plateau, Trabzon. Food
Chemistry. vol. 103 1426–1433
Cortés M.; García A.; Suarez
H. (2007) Fortificación de hongos
comestibles (Pleurotus ostreatus) con
Calcio, Selenio y vitamina C. Vitae. vol
14:1 16-24
Deumier F.; Trystram G.; Collignam A.;
Güedider L.; Bohuon Ph. (2003). Pulsed
vacuum brining of poultry meat: interpretation
of mass transfer mechanisms. Journal of
Food Engineering. Vol. 58-93
García W. C. L..; Giraldo G. G.
A.1,; Hernando URTADO T. H. y Mendivil
C.O. (2006) Cinética Enzimática
de la Polifenol Oxidasa del banano Gros
michel en diferentes estados de maduración.
VITAE, Volumen 13 número
2 13-19
Giri S.K.; Prasad S. (2007) Drying kinetics
and rehydration characteristics of microwave-vacuum
and convective hot-air dried mushrooms.
Journal of Food Engineering Vol 78 512-521
Gowen A.; Abu-Ghannam N.; Frias J.; Oliveira
J. (2006). Optimisation of dehydration
proprieties of cooked chickpeas (Cicer
arietinum L.) undergoing microwave-hot
air combination drying. Food Science
& Technology Vol. 17 177–183
Jayakumar E.; Ramesh E.; Geraldine P.
(2006). Antioxidant activity of the oyster
mushroom, Pleurotus ostreatus, on CCl4-induced
liver injury in rats. Food and Chemical
Toxicology. Vol. 44 1989-1996
Jolivet S.; Arpin N.; Wichers H.; Pellon
G. (1998) Agaricus bisporus browning:
a review. Mycol. Res. Vol. 102 (12)
: 1459±1483.
Kotwalwale N.; Bakane P.; Verma A. ( 2007)
Changes in textural and optical properties
of oyster mushroom during hot air drying.
Journal of Food Engineering Vol.78
1207–1211
Lewick, P. P. (2006) Design of hot
air drying for better foods. A review.
Trends in Food Science & Technology
. Vol 17 153–163.
Martinez M. V.; Whitaker J. R. (1995)
The biochemistry and control of enzymatic
browning. Trends in Food Science &
Tecnnology. Vol. 6 195-200.
Martinez M. V.; Whitaker J. R. (1995)
The biochemistry and control of enzymatic
browning. Trends in Food Science &
Tecnnology. Vol. 6 195-200
Martinez N.N.. M. Ana; Grau A.Chiralt
B. A.; Fito M. P. Termodinámica
y Cinética de Sistemas Alimento
Entorno. Universidad Politécnica
de Valencia. Editorial U.P.V. Edita
495 public@ upvnet.upv.es. 1998. Págs:
319-320
Murugesan A.G.; Vijayalakshmi G. S.; Sukumaran
N.; Mariappan C. (1995). Utilization of
Water Hyacinth for Oyster Mushroom Cultivation.
Bioresource Technology. Vol 51 97 –
98
Piltz D.; Molina R. (2002) Commercial
harvests of edible mushrooms from the
forests of the Pacific Northwest United
States: issues, management, and monitoring
for sustainability. Forest Ecology and
Management Vol. 155 3 – 16
Rodríguez, N.; Gómez, F.
A. (2001) Producción de hongos
comestibles. CENICAFE, Avances técnicos
285.
Ruiz M.; Cortés M.; Henríquez
L. (2010) Efecto de dos atmósferas
de empaque en hongos comestibles (Pleurotus
ostreatus spp.) Tratados mediante una
solución conservante. Vitae Vol
17 11- 19
Sacchetti G.; Gianotti A.; Rosa M. D.
(2001) Sucrose-salt combined effects on
mass transfer kinetics and product acceptability.
Study on Apple osmotic treatments. Journal
or Food Engineering. Vol 49 163-173
Toivone P.; Brumell D. (2008) Review.
Biochemical bases of appearance and texture
changes in fresh-cut fruit
and vegetables. Postharvest Biology and
Technology Vol. 48 1–14
Torreggiani D.; Bertolo G. (2001). Osmotic
pre-tratments in fruit processing: chemical,
physical and structural effects. Journal
of food Egineering. Vol 49 247-253
Walde S. G.; Velu V.; Jyothirmayi T.;
Math R.G. (2006). Effects of pretreatme
and drying methods on dehydration of mushroom.
Journal of Food Engineering Vol.
74 108–115
Wong J. Y; Chye F. Y. (2009) Antioxidant
properties of selected tropical wild edible
mushrooms. Journal of Food Composition
and Analysis. Vol.22 (269–277).
Zhao Y.; Xieb J. (2004) Practical applications
of vacuum impregnation in fruit and vegetable
processing. Trends in Food Science &
Technology. Vol. 15 434-451
|
