|
RESUMEN
Debido
a la creciente contaminación por
cromo de la Laguna de Sonso, Valle de Cauca,
se han buscado alternativas para generar
procesos de bioacumulación de este
metal dentro del tejido micelial del hongo
Pleurotus ostreatus (buchon de agua), utilizando
el buchón de agua como sustrato.
Se evaluó en laboratorio y en invernadero
el comportamiento del hongo P. ostreatus
en tres concentraciones de cromo (30, 60
y 90 ppm).
En
laboratorio se utilizó como medio
papa-dextrosa y en invernadero tejido vegetal
de la planta bioacumuladora Eichhornia crassipes.
Tanto en laboratorio como en invernadero,
se observó la presencia de cromo,
el cual inhibió el crecimiento del
hongo. El cromo es un factor limitante para
el crecimiento del hongo.
PALABRAS
CLAVE
Biorremediación, bioacumulación,
Pleurotus ostreatus, Eichornia crassipes.
ABSTRACT
Due to the growing problem of pollution
in the waters of Sonso Lagoon, Valle del
Cauca, heavy metals such as chromium was
raised an investigation that would identify
alternatives for bioaccumulation processes
of this metal into the fabric of mycelial
fungus Pleurotus ostreatus using the hyacinth
water as a base substrate.
The fungus P. ostreatus was evaluated at
three different concentrations of chromium
(30, 60 and 90 ppm) and a control, for two
cases at the laboratory in liquid medium
potato-dextrose and level of greenhouse
grown in a base substrate plant tissue of
the bioaccumulator plant Eichornia crassipes
Solms Mart. There was, for the test in laboratory
and greenhouse, that the presence of Cr
in the middle slowed and inhibited growth
of the fungus. Therefore it was concluded
that Cr is a limiting factor for the growth
of P. ostreatus.
1. INTRODUCCIÓN
Debido a la fuerte contaminación
de las aguas del río Cauca y sus
afluentes se ha detectado proliferación
del buchón de agua, Eichhornia crassipes,
en la Laguna de Sonso, condición
que limita el desarrollo de la biota de
la laguna. Esta masa densa de vegetación
flotante obstaculiza el paso de la luz solar
y el intercambio de gases con la atmósfera
y destruye otras formas de vida vegetal
y animal existentes.
Aún
con estos efectos negativos el buchón
de agua se ha convertido en un elemento
de importancia desde el punto de vista de
la biorremediación porque posee potencial
para capturar metales pesados, tales como
arsénico, cadmio, cromo y mercurio,
entre otros, en fuentes hídricas
contaminadas. De esta manera el buchón
juega un papel importante en la descontaminación
de la laguna, acumulando los metales, pero
a la vez ha generado otros problemas ambientales
(Pedraza, 1994).
La contaminación por metales pesados
en la laguna requiere alternativas que permitan
disminuir la proliferación del buchón
de agua y, en forma asociada, la concentración
de metales pesados, específicamente
de cromo, causante de graves daños
al ambiente y a la salud humana debido a
su alta toxicidad. Paralelamente el depósito
del buchón fuera del agua en la orilla
de la Laguna conlleva a su descomposición,
liberando los metales acumulados (Tapia,
2002).
A fin de conocer la capacidad de biorremediación
del hongo Pleurotus ostreatus se ha propuesto
retirar el buchón de agua de la laguna
para ser utilizado como sustrato para el
cultivo de este hongo y, de esta forma,
analizar la capacidad de bioacumulación,
como una alternativa para mantener el cromo
aislado del agua y el suelo. La adopción
de tecnologías biológicas
conduce a la conservación de áreas
naturales y a su restablecimiento (Rodríguez,
2005).
En esta investigación se analizó
el comportamiento in vitro del hongo P.
ostreatus con concentraciones de (Cr 6+
) similares a las de los sedimentos de la
Laguna (30, 60 y 90 ppm) y a nivel de invernadero,
en donde se preparó un sustrato a
base de buchón de agua tratado con
idénticas concentraciones de Cr 6+
(30, 60 y 90 ppm) con el propósito
de observar si P. ostreatus crece y desarrolla
cuerpos fructíferos en este sustrato
con cromo y determinar si puede extraer
y acumular el metal en sus estructuras(Favero,
1990).
2. METODOLOGÍA
Se evaluó el comportamiento del hongo
Pleurotus ostreatus a partir del crecimiento
micelial en sustratos con cromo (VI), con
el fin de determinar su utilidad dentro
de procesos de biorremediación, que
expliquen la bioacumulación del metal
pesado.
2.1.
MULTIPLICACIÓN DEL HONGO
Una cepa pura del hongo Pleurotus ostreatrus
se multiplicó en medio de cultivo
papa-dextrosa-agar (PDA) y se incubó
a 25ºC de temperatura por 15 días.
Análisis del crecimiento de P. ostreatus
en medio líquido in vitro
Se realizó un ensayo a nivel de laboratorio
con el fin de determinar la capacidad del
hongo P. ostreatus para crecer en medio
líquido con diferentes concentraciones
de cromo.
Se utilizó medio líquido con
Papa-dextrosa en agua destilada. El medio
se dividió en tres tratamientos equivalentes
a concentraciones de 30, 60 y 90 ppm de
Cr6+ obtenido a partir de dicromato de potasio
(K2Cr2O7). Cada concentración tuvo
cinco repeticiones y un control (Tabla 1).
Los tratamientos se mantuvieron a 25 °C
por 30 días.
Tabla
1. Peso de dicromato de potasio (K2Cr2O7)
utilizado para la preparación de
los tratamientos en medio líquido
para el análisis in vitro
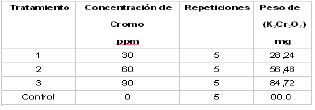
.
Análisis del crecimiento del micelio
de P. ostreatus en medio líquido
con concentraciones de Cr6+ de 30, 60 y
90 ppm
Se
realizaron observaciones cada cinco días
en todos los tratamientos y el control para
determinar el crecimiento micelial de P.
ostreatus, el cual se identificó
por la aparición de una masa blanca
de textura algodonosa en la superficie del
medio, con crecimiento de tipo radial.
2.2.
PREPARACIÓN DE SUSTRATOS A BASE DE
Eichhornia crassipes
Recolección
del material vegetal
La planta acuática Buchón
de agua (Eichhornia crassipes) se colectó
en la Laguna de Sonso, Valle del Cauca,
ubicada sobre la margen derecha del río
Cauca, entre los municipios de Buga, Yotoco
y Guacarí . Las plantas sanas de
30 cm de longitud se seleccionaron de la
orilla de la Laguna.
El material colectado se lavó con
agua corriente con el fin de desprender
restos de sedimento de la laguna. Se colocaron
en recipientes plásticos con agua
corriente y se dejaron reposar por ocho
días para liberar el exceso de metales
contenidos en el tejido.
Tratamiento de Buchón de agua (E.
crassipes) con diferentes concentraciones
de cromo
Se prepararon 10 acuarios con capacidad
para 25 litros, los cuales se llenaron con
20 litros de agua corriente y a cada uno
se le agregó la cantidad de dicromato
de potasio (K2Cr2O7) correspondiente según
el tratamiento. (Foto1).

Figura
1. Acuarios de vidrio con tratamientos de
cromo a 30, 60 y 90 ppm.
Los
acuarios se dividieron, según se
muestra en la Tabla 2, para el número
de tratamientos con cromo. Las concentraciones
de cromo para los tratamientos se calcularon
con base en datos obtenidos en estudios
preliminares en la Laguna de Sonso por (Calero,
comunicación personal) (Tabla 2).
Tabla
2. Pesos de dicromato de potasio utilizados
para la preparación de los tratamientos
para las plantas de E. crassipes.
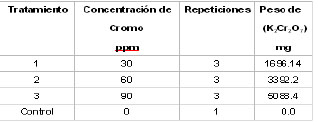
En cada acuario se colocaron un total de
11 plantas sanas de buchón de agua.
Las plantas permanecieron en los acuarios
con los diferentes tratamientos por un periodo
de ocho días (Foto 2).

Figura 2. Tratamientos de Buchón
de agua, E. crassipes, a diferentes concentraciones
de cromo.
Ocho
días después se tomó
una muestra de 10 gramos en peso seco de
material vegetal por cada tratamiento con
el fin de realizar un análisis químico
por el método de llama en el Laboratorio
de Análisis Químico e Industrial
de la Facultad de Ciencias de la Universidad
del Valle para calcular la cantidad de cromo
absorbido por las plantas.
El material restante fue extraído
de los acuarios y se cortó en trozos
de entre 1 y 3 cm2 , incluyendo hojas, tallo
y raíces de las plantas. El material
fue colocado en bolsas de polietileno de
alta densidad y posteriormente se llevó
a autoclave por 15 minutos a 121°C y
15 atmósferas de presión con
el fin de eliminar los microorganismos presentes
en el material.
Se prepararon 40 bolsas con material vegetal
en las cuales se sembró el hongo
P. ostreatus. Se realizaron cuatro tratamientos
con diez repeticiones(Tabla 3).
Tabla
3 Distribución de matrices por tratamiento.
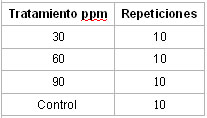
En
cada una de las bolsas se depositaron 10
fragmentos del micelio de P. ostreatus.
Los tratamientos se incubaron por un periodo
de 60 días.
3.
RESULTADOS Y DISCUSIÓN
ANÁLISIS
DEL CRECIMIENTO DE P. ostreatus IN VITRO
El
control mostró desarrollo micelial
abundante de textura afelpada sobre la superficie
del medio líquido. Después
de diez días el hongo presentó
un diámetro de 4.0 cm.
Los tratamientos con concentraciones de
Cr6+ de 30, 60 y 90 ppm no evidenciaron
crecimiento micelial después de diez
días de inoculados.
Se realizó una segunda evaluación
después de 30 días de la inoculación.
Los resultados mostraron crecimiento micelial
abundante en el control. No se observó
crecimiento en los tratamientos con cromo
(30,60 y 90 ppm).
El comportamiento observado en los análisis
de crecimiento in vitro indican que P. ostreatus
no es tolerante a las concentraciones de
cromo utilizadas (30, 60 y 90 ppm), puesto
que no se observó ninguna señal
de crecimiento del micelio. Sin embargo,
ésta no constituye una prueba definitiva,
ya que si bien los experimentos con metales
pesados en medios líquidos proveen
datos útiles acerca de la capacidad
del hongo para la captura de estos metales,
éstos no reflejan con exactitud la
situación en la naturaleza. Es decir,
el comportamiento del hongo podría
variar con respecto a otras condiciones
en donde sí podría observarse
crecimiento y desarrollo del hongo.
Concentraciones
de cromo acumuladas por la planta E. crassipes
a partir de los tratamientos a diferentes
concentraciones del metal
Las plantas de E. crassipes sometidas a
los tratamientos con cromo de 30,60 y 90
ppm mostraron un buen crecimiento en los
acuarios, pues no se observaron plantas
con hojas secas, amarillas o plantas muertas.
Los análisis químicos realizados
al tejido de las plantas con el fin de determinar
la presencia de cromo demostraron que hubo
absorción y acumulación del
metal por parte de las plantas. Las cantidades
absorbidas se pueden observar en la Tabla
5.
Los resultados permiten verificar que el
tejido utilizado como sustrato a partir
de estas plantas fue portador de cantidades
significativas de cromo, aptas para realizar
los tratamientos.
Sin embargo, como se puede observar para
el control, el tejido de las plantas conservó
una cantidad de 18.7 mg/L de cromo, a pesar
del tiempo (16 días) que las plantas
se mantuvieron en reposo con agua limpia.
El buchón de agua presenta una gran
capacidad acumulativa de cromo, lo cual
se ha demostrado en otros estudios (Faisal
et al. 2003), en los cuales se ha
Tabla
5. Cantidad de cromo absorbido por las plantas
de E. crassipes sometidas a 30, 60 y 90
ppm de Cr6+
 . .
observado que las plantas toleran fácilmente
concentraciones hasta de 2000 mg de cromo
sin síntomas visibles de la toxicidad
del metal, al igual que lo observado en
esta investigación. Lo anterior se
debe a la capacidad genética que
tiene el buchón de agua como planta
fitoextractora para interceptar, absorber
y acumular los metales en sus estructuras
(Lasat, 2002).
Como
se observa en la Tabla 5 las cantidades
de cromo absorbidas por las plantas de E.
crassipes aumentaron con respecto a la cantidad
de cromo en el medio; esto se debe a que
la toma de metal por esta planta es dependiente
de la concentración (Faisal op. cit.),
de manera que si aumenta la concentración
inicial del cromo en el medio también
aumenta la captura y la acumulación
de éste por parte del buchón
de agua.
Crecimiento
del micelio de Pleurotus osteatrus en unidades
de tejido de Eichornia crassipes con diferentes
concentraciones de cromo
En el control se observó un leve
crecimiento del micelio de 6 a 8 cm de diámetro
sobre una porción del sustrato; éste
fue de color blanco opaco con apariencia
delgada y pobre, el cual creció de
forma irregular, dejando zonas intermedias
sin crecimiento de hifas. Este comportamiento
se observó en cuatro repeticiones
del control desde el día 8 hasta
el día 12, a partir del cual el micelio
adquirió una apariencia seca y detuvo
su crecimiento.
En los tratamientos con 2292.6 y 3043 mg/L
de cromo se desarrolló un micelio
pobre y delgado de color blanco, con crecimiento
irregular de tres a cuatro cm de diámetro
sobre una porción del sustrato. Esto
se observó en tres unidades al cabo
del día 15; a partir del día
18 el micelio detuvo su crecimiento, adquiriendo
una apariencia de color pardo y una textura
seca.
En el tratamiento correspondiente a las
unidades con 4832.4 mg/L de cromo no hubo
crecimiento de micelio en ninguna de las
unidades (Tabla 6).
Comportamiento del hongo P. ostreatus al
ser inoculado sobre sustratos con presencia
de cromo.
Se consideró como medida de evaluación
del comportamiento del hongo el crecimiento
del micelio, debido a que éste es
el fenómeno complejo más utilizado
para estudiar la toxicidad de los metales
pesados (Baldrian, 2002).
Los
datos obtenidos de las medidas de crecimiento
del micelio de P. ostreatus sobre el sustrato
de buchón de agua con diferentes
concentraciones de cromo (2292.6, 3043 y
4832.4 mg/l) no presentaron una distribución
normal, según la prueba de bondad
de ajuste de Kolmogorov Smirnov. Posteriormente,
el contraste unilateral de Kruskal-Wallis
indicó que no existen diferencias
significativas entre los promedios de los
crecimientos del micelio en las diferentes
concentraciones de Cr6+ (2292.6, 3043 y
4832.4 mg/L).
Es
necesario resaltar que el hongo P. ostreatus
se comportó diferente de acuerdo
con el sustrato sobre el cual se inoculó.
Aunque no creció en las pruebas in
vitro con medio líquido a base de
almidón de papa, en invernadero sí
mostró un crecimiento muy leve en
algunas de las unidades del control y los
tratamientos con 2292.6 y 3043mg/l de Cr6+.
Estos resultados pueden deberse en parte
a las diferencias no sólo nutritivas
entre los sustratos (papa dextrosa Vs buchón
de agua) sino a las diferencias de Cr6+
contenidas en los medios.
En
los análisis in vitro el cromo de
los tratamientos se hallaba en relación
con los promedios de cromo contenidos en
los sedimentos de la Laguna de Sonso, de
manera que el análisis indicó
el comportamiento del hongo al ser sometido
directamente a las concentraciones de cromo
presentes en el sedimento cuando éste
presenta contenidos del metal pesado en
cantidades medias (60 ppm), altas (90 ppm)
y bajas (30ppm),
Tabla
6. Medidas del crecimiento (en cm) del micelio
del hongo P. ostreatus sobre los sustratos
a base de E. crassipes con diferentes concentraciones
de cromo.
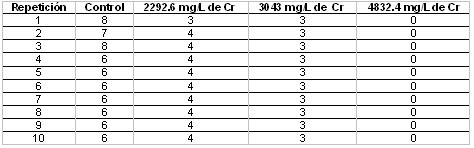
arrojando
como resultado la ausencia de crecimiento
de P. ostreatus.
En
los análisis sobre el sustrato a
base de E. crassipes las concentraciones
de Cr6+ fueron diferentes debido a que dependieron
de la capacidad de la planta para acumular
el metal. Este ensayo indica el comportamiento
del hongo si se utiliza buchón sacado
de la Laguna de Sonso como sustrato para
su crecimiento, cuando éste haya
acumulado diferentes cantidades de cromo
relativas al contenido alto, medio y bajo
de este metal pesado en la Laguna.
PEl
hongo leurotus ostreatus ha demostrado tener
la capacidad de acumular metales pesados,
como cadmio (Favero et al op. cit.), cobre
(Baldrian P. op. cit.) y plomo (Rodríguez
op. cit.), pero los resultados obtenidos
en esta investigación indican que
con respecto al cromo el hongo presenta
un comportamiento distinto, según
Baldrian P. (op. cit.) Esto puede explicarse
probablemente debido a que la preferencia
de los hongos por metales pesados individuales
es especie-específica. No es sorprendente
que diferentes especies de hongos de pudrición
blanca difieran en el grado de su tolerancia
a los metales pesados. Según Palmans
et al. (citado por Baldrian P. (op. cit.))
T. vesicolor mostró desarrollo y,
por lo tanto, resistencia frente a los metales
Cd, Zn, Ni, Co, Cr, Mo, Pb, Hg, y Sn, mientras
que A. mellea, Lentinus sp, Pholiota nameko,
Pleurotus sp., Pycnoporus sanguineus y S.
comune mostraron ser claramente menos resistentes
debido a que su desarrollo se vio retardado
o inhibido.
El crecimiento de micelio de P. ostreatus
observado en algunas de las unidades de
los tratamientos con tejido de E. crassipes
indica que el hongo inició su desarrollo
sobre el sustrato, pero que debido a una
interacción con el Cr6+ detuvo su
crecimiento.
Los hongos de pudrición blanca, como
Pleurotus, poseen la capacidad de secuestrar
trazas esenciales de iones de metal de varios
medios, donde pueda estar presente en concentraciones
desde traza hasta niveles tóxicos.
Sin embargo, estos hongos poseen un problema
específico, porque el desarrollo
fungal puede ser inhibido por algunos iones
de metales pesados. Baldrian P. (op. cit.)
indica que los metales pesados como el cromo,
presentes en el ambiente, pueden interactuar
directamente con las enzimas extracelulares
del hongo y,a su vez, pueden causar una
respuesta fisiológica si los metales
son tomados por el hongo.
Los
efectos tóxicos del cromo observados
en el hongo P. ostreatus a nivel de cambios
morfológicos deben explicarse a partir
de la entrada del metal en la célula
fúngica, ya que una vez adentro este
metal pesado puede afectar tanto reacciones
individuales como procesos metabólicos
complejos.
Sin embargo, los mecanismos moleculares
de acumulación de metales pesados
por hongos de pudrición blanca no
han sido estudiados. En otras especies de
hongos, los sistemas transportadores para
la toma de metales esenciales se encuentran
en la membrana celular. Los no esenciales
usualmente son cotransportados usando los
mismos transportadores debido a su baja
especificidad. La toma depende parcialmente
del potencial de la membrana, luego el metal
pesado es enlazado a un transportador de
calcio. En el nivel subcelular, 50% del
metal se encuentra unido a la pared celular,
30% permanece en el citoplasma y 20% es
transportado dentro de las vacuolas.
Los
cambios en la morfología del micelio
de P. ostreatus se caracterizaron por crecimiento
irregular con ausencia de hifas en algunos
segmentos y apariencia reseca. Estos efectos
se pueden explicar desde el punto de vista
de la toxicidad de los metales pesados como
el Cr6+ en las enzimas extracelulares. En
éstas se desarrolla un complejo metabólico
energético de actividad degradadora
de celulosa, hemicelulosa y lignina. Estas
enzimas, producidas en el ambiente extracelular,
a menudo muestran altas concentraciones
de metales debido a que éstas no
son protegidas por los mecanismos de detoxificación
de metales asociados a las células
(Baldrian P. op. cit.). Por lo tanto, al
verse afectadas por los efectos oxidativos
de los iones de cromo hexavalente, la actividad
degradadora de estas enzimas extracelulares
en el sustrato disminuyó, afectando
directamente el desarrollo del micelio de
P. ostreatus.
El Cr6+, por ser un metal pesado, pudo comportarse
como un potente inhibidor de las reacciones
enzimáticas del hongo P. ostreatus.
Un ejemplo de esto son los efectos producidos
por otros metales pesados como el mercurio,
el cual ejerce su efecto tóxico,
principalmente al vincularse a los grupos
SH presentes en los sitios activos o de
regulación enzimática, causando
la inactivación irreversible de las
enzimas. El cobre y el cadmio también
tienen la capacidad de unirse a los residuos
de aminoácidos aromáticos
en las moléculas enzimáticas,
acusando daños oxidativos de las
proteínas por la inducción
de estrés oxidativo asociado con
la producción de oxígeno reactivo
como el hidroxyl o radicales superóxidos
(Baldrian P. op. cit.), de manera que al
entrar en contacto con las enzimas celulares
de P. ostreatus, el Cr6+ pudo haber interferido
en sus funciones inactivándolas de
manera permanente, inhibiendo así
el crecimiento del micelio en las unidades.
La
asencia de crecimiento uniforme del micelio,
caracterizada por espacios sin crecimiento
en medio de las hifas, pudo haberse presentado
por permeabilización de la membrana
plasmática, lo cual ocasiona el vaciado
del contenido citoplasmático y la
muerte de las hifas. Este comportamiento
se ha observado con otros metales pesados
similares al Cr6+, como el cadmio y el cobre,
los cuales ejercen su efecto tóxico
directamente en la membrana plasmática,
donde interfieren con solutos transportadores
y otros fenómenos membranales, causando
permeabilización de la membrana y
cambios en su composición (Baldrian
P. op. cit.).
4. AGRADECIMIENTOS
Los autores expresan su agradecimientos
a la la Universidad del Valle, a través
de la Vicerrectoría de Investigaciones
por la financiación del estudio.
5. REFERENCIAS BIBLIOGRÁFÍCAS
Axtell, C., Johnston C. y Bumpus J. (2000).
Bioremediation of Soil Contaminated with
Explosives at the Naval Weapons Station
Yorktown.
Soil and Sediment Contamination. 9 /6
: 537-548.
Baldrian,
P. (2002) Interactions of heavy metals
with white-rot fungi. Enzyme and Microbial
Technology. 32: 78-91.
Camargo,
F.M., Bento, B.C., Okeke, W.T. y Frankenberger.(2003)
Chromate Reduction by Chromium-Resistant
Bacteria Isolated from Soils Contaminated
with Dichromate. Journal Environmental
Qual. 32/4 :1228-33
Faisal,
M.y Hasnain, S. (2003). Synergistic removal
of Cr (VI) by Eichornia crassipes in conjunction
with bacterial strains. Pakistan. Journal
of Biological Sciences. 6/3 : 264-268.
Favero,
N., Bressa, G. y Costa, P. (1990). Response
of Pleurotusostreatus to cadmium exposure.
Ecotoxicology and environment safety.
20/1: 1-6.
Gischler,
C. (2005). Pathways of heavy metals and
implications for stakeholders, Sonso Lagoon,
Colombia. Tesis de maestría en
Ingeniería Ambiental. Royal Institute
of Technology of Sweden.
Guerra,
M. y Duran, M.(2005). Producción
de Pleurotus ostreatus en residuos de
madera y coco en el municipio de Buenaventura,
Valle del Cauca. Producción artesanal
de hongos comestibles.
Jauregui,
J., Valderrama, B., Albores, A. y Vazquez-Duhalt,
R.(2003). Microsomal transformation of
organophosphorus pesticides by white rot
fungi. Biodegradation. 14:397-406.
Lasat,
M. (2002). Phytoextraction of toxic metals.
Journal of Environmental Quality 31:109-120.
Llugany,
M., Torla, R., Poschnrieder, C. y Barcelo,
J. (2007). Hiperacumulación de
metales: ¿una ventaja para la planta
y el hombre? Ecosistemas Revista de Científica
y Técnica de Ecología y
Medio Ambiente. 2 :1-6.
Marcovecchio,
J.E., Moreno, V.J. and A. Pérez.(1991).
Metal accumulation in tissues of sharks
from the Bahía Blanca Estuary,
Argentina. Marine Environmental Research.
31: 263-274.
Mitch
M., (2002). Phytoextraction of Toxic Metals
A Review of Biological Mechanisms. Journal
of Environmental Quality 31:109-12.
Pedraza.
G. X. (1994). Reciclaje del efluente de
Origen animal con tres especies de plantas
acuáticas. Livestock Research for
Rural Development. 671: 1-7.
Rodríguez,
K. J. (2005). Eficacia del hongo Pleurotus
ostreatus como biorremediador de suelos
contaminados con metales pesados.Tesis
de maestría en ciencias de biología.
Universidad de Puerto Rico.
|
