| |
Identificación de Microorganismos
antagonistas del HONGO Fusarium sp. en órganos
de Heliconia spp.
Antagonists’ microorganisms
of Fusarium sp. in organs of Heliconia spp.
|
| |
|
|
|
*Aceptado: 13 Septiembre
2013
|
Yolima
Andrea Arenas, B.Sc.
Investigadora
Departamento de Biología, Universidad del
Valle,
Cali, Colombia
|
Celina
Torres-González, M.Sc.
Profesora Asociada
Departamento de Biología, Universidad del
Valle,
Cali, Colombia
|
| yoliare@hotmail.com
|
celina.torres@correounivalledu.co
|
Jaime
Ernesto Díaz Ortiz, Ph.D.
Profesor Titular
Escuela de Ingeniería de Recursos Naturales
y del Ambiente, Universidad del Valle, Cali, Colombia
|
|
| jaime.diaz@correounivalle.edu.co
|
|
RESUMEN
Se
identificó el comportamiento de microorganismos
antagonistas del hongo Fusarium sp., un patógeno
de los tallos, las raíces, las inflorescencias
y las hojas de Heliconia sp, con el propósito
de encontrar alternativas para el control de enfermedades
ocasionadas por éste. Se evaluó la actividad
antagónica frente a Fusarium sp. aislando cinco
hongos encontrados en distintos órganos del cultivo
de Heliconia sp., se almacenaron en bolsas herméticas
y se conservaron a baja temperatura hasta el momento
de procesarlas en el laboratorio. La actividad antagónica
entre las morfoespecies de Alternaria sp., Aspergillus
sp. (1 y 2), Nigrospora sp. (1 y 2), Papulospora sp.,
y Trichoderma sp. (1 y 2) frente a las seis subespecies
de Fusarium sp. fue mayor, especialmente después
de 168 horas de crecimiento. En algunos casos el diámetro
promedio de los antagonistas invadió el área
micelial del Fusarium sp. Se encontró que algunos
hongos presentes en diferentes partes de la planta actúan
como antagónicos (Alternaria sp., Aspergillus
sp. Nigrospora sp., Papulospora sp. y Trichoderma sp)
y contribuyen a reducir la severidad de ataque de otros
fitopatógenos más agresivos, demostrando
así su potencial como agentes antagónicos
de Fusarium sp.
PALABRAS CLAVE
Hongos, Fusarium sp., antagonismo, microorganismos
ABSTRACT
Studies on the behaviour of Fusarium sp., microorganisms
antagonists pathogenic of stems, roots, inflorescence
and leaves of Heliconia sp, was realized, with the purpose
to find alternatives for control of illnesses caused
by this organism. The activity antagónistic front
to Fusarium sp., isolating five funguses found in Heliconia
sp. crop was evaluated and stored in hermetical bags
and preserved in cold. The activity antagónistic
between the species of Alternaria sp., Aspergillus sp.
(1 And 2), Nigrospora sp. (1 And 2), Papulospora sp.,
and Trichoderma sp. (1 And 2) front to the six subespecies
of Fusarium sp., was main, especially after 168 hours
of growth. In some cases the diameter average of the
antagonistics has grown on Fusarium sp micelial area.
Found that some present funguses in different organs
of the plant act like antagónistic (Alternaria
sp., Aspergillus sp. Nigrospora sp., Papulospora sp.
and Trichoderma sp), and contribute to reduce the severity
of attack of other fitopatógenos more aggressive,
showing like this, his potential like agents antagónistic
of Fusarium sp.
KEY WORDS
Funguses, Fusarium sp., antagonism, microorganisms.
1. INTRODUCCIÓN
En
la actualidad existe una demanda internacional creciente
de producción de flores exóticas. En Colombia
el primer lugar en la exportación de flores lo
representa el grupo de rosas, clavel y crisantemos con
el 68,3% ; el 31,7% restante está conformado
por las flores tropicales , donde están incluidas
las heliconias (PROEXPORT, 2008). Este renglón
económico está expuesto al ataque de enemigos
naturales (hongos, virus, bacterias o insectos), que
inciden en su productividad. El incremento de áreas
cultivadas con heliconias, potencia el desarrollo de
problemas fitosanitarios (Kress et al., 1993). En cultivos
comerciales las medidas de control se basan en el uso
de agroquímicos, práctica que lentamente
está variando a la implementación de controles
biológicos con el propósito de proteger
y mitigar el impacto sobre los ecosistemas. Para implementar
estas alternativas es necesario conocer la biología
de los organismos que interactúan en los cultivos
(Agrios, 2005).
En
el control biológico de fitopatógenos,
los organismos antagonistas juegan un papel muy importante
por presentar características de agresividad,
persistencia, rápido crecimiento, desarrollo
y capacidad de colonizar el medio donde se encuentra
el agente causal de la enfermedad, aun en condiciones
de “stress” nutricional (Saldarriaga y Pineda,
2001). Tales características se presentan en
la especie del género Fusarium sp.
El
antagonismo como mecanismo se basa en la activad inhibitoria
directa que ejerce un microorganismo sobre otro y que
presenta acciones opuestas en un mismo sistema (Cotes,
1993). En la micro-biota del suelo existe una gran variedad
de microorganismos que ejercen actividad antagónica
contra patógenos de plantas, manteniendo de esta
manera un equilibrio natural (Trapero, 2000). Se conocen
algunos organismos que afectan las plantaciones de Heliconia,
entre ellos: Alternaria, Fusarium oxysporum, Drechslera
musae-sapientum, Phyllosticta musae, Glomerella cingulata,
Gloeosporium musarum, Colletotrichum musae, Guignardia
musas, Curvularia sp, Mycosphaerella musicola y Pestalotia
sp. Es necesario desarrollar técnicas alternativas
de control biológico, basadas en la identificación
de las características de diversas especies de
hongos, con el fin de sustituir o disminuir el uso de
productos químicos (Madriz et al., 1991).
En
la rizósfera se presenta una competencia continua
por espacio y alimento entre los microorganismos que
la habitan. Ciertas especies de Trichoderma tienen un
potencial antagónico debido a su potencial para
producir compuestos anti-fúngicos, enzimas extracelulares
y sustancias antibióticas (Harman et al., 1996).
También a la capacidad de luchar por espacio
y nutrientes frente a otros hongos. Fuera de estas características,
es un agente promotor del crecimiento de las plantas
e inductor de la resistencia sistémica (Hermosa
et al., 2000).
Trichoderma
es un organismo saprofito natural del suelo, lo cual
le proporciona ventajas, tales como antibiosis, competencia
por nutrientes, espacio y micoparasitismo, mecanismos
que actúan coordinadamente. Su importancia en
el proceso de bio-control depende de la cepa de Trichoderma
empleada, el hongo que se requiere controlar, el tipo
de planta o cultivo y algunas condiciones ambientales,
como pH, disponibilidad de nutrientes, humedad relativa,
temperatura y concentración de hierro (Benítez
et al., 2004).
Entre
los fitopatógenos que puede controlar Trichoderma
sp., se encuentran Fusarium oxysporum, Phytophthora
nicotianae, Phytophthora cinnamomi, Phytophthora capsici,
Phytophthora Cactorum, Rhyzoctonia solani, Pythium sp.,
Sclerotinia sclerotiorum, Colletotricum gloesporioides,
Sclerotium rolfsii, Rosellinia bunodes, Botrytis cinerea
Armillaria mellea, Phytium sp. y Cryptonectria parasítica
(Cole Zyenyika, 1988).
Trichoderma
sp. tiene la capacidad de colonizar y adaptarse a diferentes
clases de sustratos en condiciones controladas, generando
como resultado una limitación del crecimiento
de los organismos (Borrero y Silva, 2005). Los estudios
para controlar el fitopatógeno Fusarium oxysporum
en cultivares de tomate empleando Trichoderma sp. presentan
porcentajes de preemergencia de semillas equivalentes
al 66,9% (Betancourt y Kress, 1993), demostrando su
capacidad protectora. Se han reportado porcentajes de
control de Rhizoctonia solani y F. oxysporum sp. en
cultivos de tomate de 68% y 70 %, respectivamente, usando
controladores biológicos como Trichoderma sp.
(Cárdenas, 1999). Estas consecuencias indican
la eficacia de usar agentes antagónicos como
control biológico.
Algunas
especies son cosmopolitas y se pueden encontrar en materia
orgánica en descomposición o son patógenas
de cereales, plantas ornamentales, frutas y hortalizas.
Otros géneros como Alternaria sp., Drechslera
sp. y Nigrospora sp. son especies distribuidas en el
suelo asociadas al detrimento de plantas y semillas
y obtienen los nutrientes necesarios para su desarrollo
del material descompuesto. En ocasiones, debido al mal
manejo de los residuos vegetales en los cultivares los
hongos pasan fácilmente del suelo a las plantas,
por lo que resulta frecuente su presencia en el follaje
de estas (Barnett y Hunter, 1972).
Existen
otros patógenos que inciden sobre el follaje,
como Collectotrichum sp., que afecta las brácteas
cuando las plantas presentan déficit nutricional.
También se han encontrado patógenos en
el suelo, como Pytium sp, Phythopthora sp y Rhizoctonia
sp, que afectan las raíces y tallos (Escalona
et al., 1992).
Fusarium
oxysporum es, predominantemente, un saprofito abundante
y activo del suelo y de la materia orgánica.
Algunas de sus cepas tienen una actividad patogénica
específica, pero constituyen una proporción
muy reducida de la población total del suelo
aunque causan enfermedades importantes en los cultivos.
Algunas se encuentran poco especializadas y causan muerte
de plántulas, necrosis o podredumbres (Smith,
1992). Actualmente hay descritas unas 80 patotipos y
varias de éstas se subdividen en biotipos (Armstrong
y Armstrong, 1981).
2. MATERIALES Y MÉTODOS
Debido a sus características saprófitas,
su actividad en el suelo y la materia orgánica,
se seleccionó como objeto de estudio el hongo
Fusarium oxysporum obtenido de muestras colectadas del
material vegetal con síntomas de enfermedad,
que fueron lavadas con agua destilada y cortadas en
trozos de aproximadamente 10 x10 mm y posteriormente
colocadas en hipoclorito de sodio al 0,5% por 30 segundos.
Posteriormente, se enjuagaron con agua destilada estéril
(ADE), procedimiento que se repitió 3 veces.
Se dejaron secar sobre papel adsorbente estéril
y se sembraron en un medio de cultivo de agar nutritivo
(AN).
Para
evaluar la actividad antagónica frente a Fusarium
sp., se escogieron cinco tipos de hongos que habían
sido aislados por Martínez (2008) del tejido
de plantas de Heliconia (Tabla 1), cultivadas en el
Parque Nacional de las Heliconias de Caicedonia (4°
19’ 25’’ N y 75°15’ W),
clasificado como bosque húmedo subtropical (bh-ST)
de acuerdo con la clasificación de Holdridge.
Estas cepas están conservadas en la Micoteca
del Laboratorio de Fitopatología de la Universidad
del Valle. Los hongos seleccionados fueron: Trichoderma
sp. (morfoespecie 1 y 2), Aspergillus sp. (morfoespecie
1 y 2), Nigrospora sp. (morfoespecie 1 y 2), Papulospora
sp, Alternaria sp. y Drechsiera sp.
Tabla
1. Presencia de hongos en los órganos evaluados
en el cultivar del Parque Nacional de las Heliconias
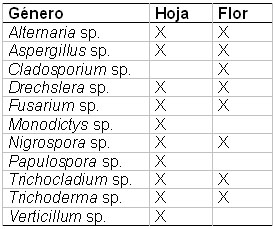
Después de la incubación de cada hongo,
se realizaron observaciones macroscópicas y microscópicas
para clasificar las colonias por el tipo de micelio
y sus características. También se observaron
sus estructuras reproductivas, para validar la determinación
de los géneros.
Con
el fin de preservar muestras viables de los hongos aislados
del follaje de heliconias por Martínez (2008)
se replicaron cultivos puros de cada patógeno
en medio de cultivo PDA. Cuando los hongos alcanzaron
un tamaño entre 5 y 7 cm de diámetro de
la colonia se tomaron 10 muestras de aproximadamente
1 cm2 y se depositaron en tubos de ensayo de 50 ml,
previamente esterilizados, que contenían, cada
uno 38 ml de ADE. De cada hongo se realizaron dos réplicas
(dos tubos de ensayo por hongo), creando así
una micoteca adicional.
Los
hongos aislados del follaje y los obtenidos de la micoteca
sobre el patógeno seleccionado (fusarium sp.)
se sembraron en PDA dentro de cajas Petri. Las muestras
se expusieron a una temperatura de 27ºC, realizando
observaciones a las 24, 48, 58, 72, 82, 120, 144 y 168
horas, con el fin de evaluar su desarrollo y comportamiento.
Se llevaron a cabo pruebas de tipo cualitativo, tomando
muestras del área de contacto entre los organismos
y del área del organismo que está siendo
afectado por la invasión del otro. El mismo procedimiento
se realizó para Fusarium oxysporum, midiendo
periódicamente el diámetro del área
micelial con un pie de rey. Los cultivos puros de las
seis morfoespecies de Fusarium mostraron características
típicas de cepas pertenecientes a la especie
Fusarium, oxysporum. Estudios realizados por Smith (1992)
demuestran que las colonias de F. oxysporum producidas
en medio APD tienen un aspecto variable que depende
de la cepa; en general, el micelio de ésta, en
su primera etapa de desarrollo, es blanco, pero a medida
que va creciendo cambia su color a distintos tonos,
desde violeta a morado oscuro y si abundan los esporodoquios
las colonias pueden aparecer crema o naranja. El medio
de cultivo se tiñe de igual color que la cepa.
Para
medir el grado de antagonismo, se construyó una
escala que calificaba la invasión del antagonista
(Tabla 2), basada en la escala utilizada por Correa
y Peñuela (2002).
Tabla
2. Escala para medir el grado de invasión del
Organismo antagónico

Se realizó la prueba de Kolmogorov–Smirnov
para determinar si los datos presentaban distribución
normal, empleando el programa PAST versión 1.8
(Hammer et al., 2001). Los datos con distribución
normal se analizaron con la prueba t student. En los
casos que no presentaron distribución normal
se utilizó el test paramétrico de Mann–Whitney,
empleando el programa PAST versión 1.8 (Hammer
et al., 2001). Se trabajo con un nivel de confianza
del 95%.
3. RESULTADOS Y DISCUSIÓN
Con excepción de Drechsiera sp., todos los demás
hongos aislados (Trichoderma sp. - morfoespecie 1 y
2, Aspergillus sp. - morfoespecie 1 y 2, Nigrospora
sp. - morfoespecie 1 y 2, Papulospora sp. y Alternaria
sp.) generaron actividad inhibitoria en Fusarium sp.
Las
Figuras 1 al 8 muestran la actividad antagónica
entre las morfoespecies de Alternaria sp., Aspergillus
sp. (1 y 2), Nigrospora sp. (1 y 2), Papulospora sp.
y Trichoderma sp (1 y 2), frente a las seis subespecies
de Fusarium sp. Se observa que a partir de las 72 horas
el promedio de los diámetros de los hongos fue
mayor que el del patógeno. Después de
las 168 horas las diferencias se incrementaron y, en
algunos casos, el diámetro promedio de los antagonistas
invadió el área micelial del Fusarium
sp.
El análisis estadístico realizado entre
los hongos patógenos aislados del follaje de
heliconias (Alternaria sp., Papulospora sp., morfoespecies
1 y 2 de Trichoderma sp. y morfoespecies 1 y 2 de Nigrospora
sp.) frente a las seis morfoespecies de Fusarium sp.
no mostró diferencias significativas en la actividad
antagónica. Sin embargo, las pruebas biológicas
señalaron un mayor crecimiento del área
micelial de los antagonistas frente a las cepas de Fusarium
sp. desde las primeras 24 horas. Pasadas 72 horas las
diferencias fueron más evidentes.
Los tratamientos que enfrentaron las morfoespecies 1
y 2 de Aspergillus sp. con las seis morfoespecies de
Fusarium sp. presentaron diferencias significativas
en la actividad antagónica entre la morfoespecie
1 de Aspergillus sp. y las morfoespecies 2, 4 y 6 de
Fusarium
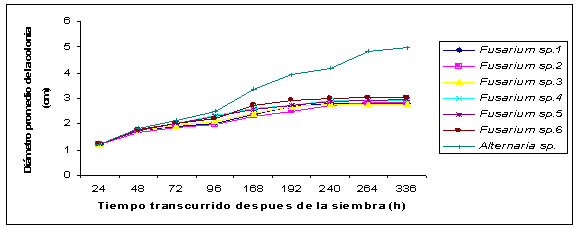
Figura
1. Tratamiento entre Alternaria sp, vs seis morfoespecies
de Fusarium sp.
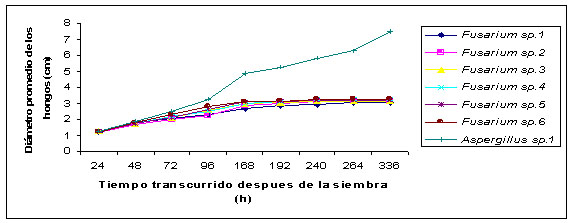
Figura
2. Tratamiento entre la morfoespecie 1 de Aspergillus
spp, vs seis morfoespecies de Fusarium sp.
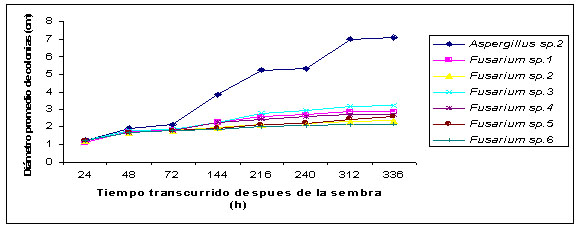
Figura
3. Tratamiento entre la morfoespecie 2 de Aspergillus
spp, vs seis morfoespecies de Fusarium sp.
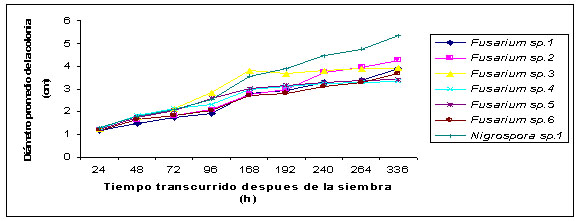
Figura
4. Tratamiento entre la morfoespecie 1 de Nigrospora
spp, vs seis morfoespecies de Fusarium sp.
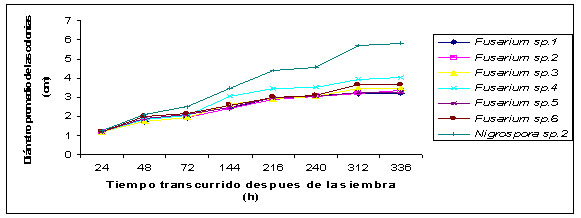
Figura
5. Tratamiento entre la morfoespecie 2 de Nigrospora
spp, vs seis morfoespecies de Fusarium sp.
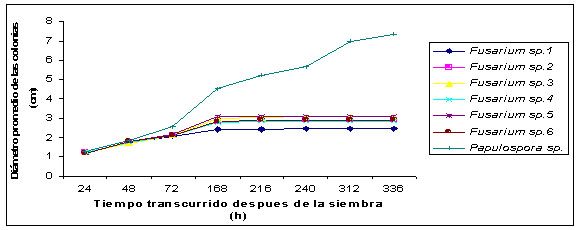
Figura
6. Tratamiento entre Papulospora sp, vs seis morfoespecies
de Fusarium sp.
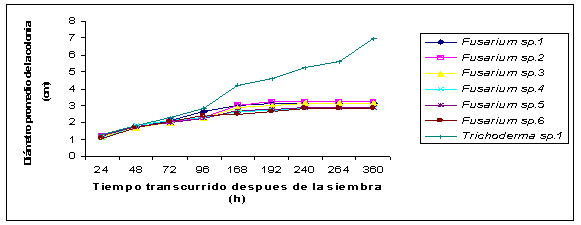
Figura
7. Tratamiento entre la morfoespecie 1 de Trichoderma
spp, vs seis morfoespecies de Fusarium sp.
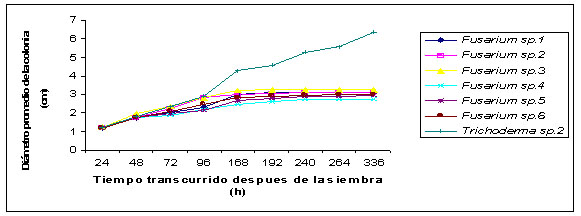
Figura
8. Tratamiento entre la morfoespecie 2 de Trichoderma
spp, vs seis morfoespecies de Fusarium sp.
Tabla 3. Niveles
de antagonismo sobre las morfoespecies de Fusarium sp.
después de 336 horas.
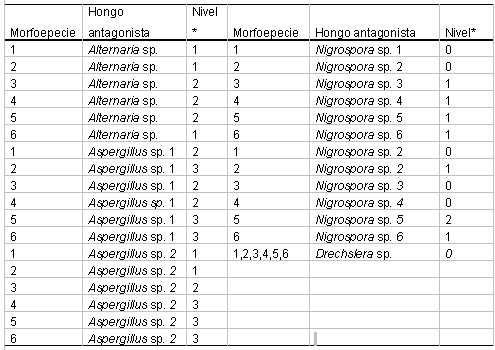
sp. El mismo resultado se encontró entre la morfoespecie
2 de Aspergillus sp. y las morfoespecies 5 y 6 de Fusarium
sp., corroborando así los resultados obtenidos
en las pruebas biológicas. Lo contrario sucedió
con las morfoespecies 1, 3 y 5 de Fusarium sp. enfrentadas
con la morfoespecie 1 de Aspergillus sp. y las morfoespecies
1,2 3 y 4 de Fusarium sp. enfrentadas con la morfoespecie
2 de Aspergillus sp., aunque estos tratamientos mostraron
presencia de actividad antagónica en las pruebas
biológicas.
El
comportamiento estadístico entre los tratamientos
de Nigrospora sp. y Fusarium sp. no presentó
diferencias significativas en la actividad antagónica
entre los organismos, pero en las pruebas biológicas
se observó un alto nivel de competencia al detener
su crecimiento las morfoespecies de Fusarium sp. en
presencia de las cepas de Nigrospora sp. También
se encontraron diferencias estadísticamente significativas
entre el tratamiento de Drechslera sp. y la morfoespecie
1 de Fusarium sp.
Los resultados obtenidos en las pruebas biológicas
con los tratamientos donde se empleó Papulospora
sp.
mostraron la presencia de actividad antagónica
por competencia de espacio. También se observó
claramente la ventaja de Papulospora sp. sobre Fusarium
sp., demostrando así el potencial como organismo
antagóni
co para ejercer un posible control biológico.
En la actualidad son pocos los estudios realizados sobre
este hongo, por lo que resulta interesante observar
su comportamiento frente a organismos patógenos
como Fusarium oxysporum.
Los
resultados obtenidos en las pruebas de antagonismo de
las dos morfoespecies de Nigrospora sp. y las seis de
Fusarium sp. demuestran su potencial como controlador
biológico de otros fitopatógenos.
4. CONCLUSIONES
Las
morfoespecies de Trichoderma evaluadas presentaron gran
capacidad antagónica frente a las morfoespecies
de Fusarium sp. por su rápido desarrollo y su
capacidad para ejercer una competencia eficaz por el
espacio al inhibir el crecimiento de Fusarium sp.
Las pruebas biológicas de los hongos del género
Nigrospora sp. mostraron presencia de actividad antagónica.
Hongos del género Nigrospora sp., que han sido
reconocidos como agentes antagonistas de Alternaria
solani (Mónaco, 1997), indican evidencias de
su potencial como antagonista de Fusarium sp.Se
confirmó que Alternaria sp. es un reconocido
antagonista de Fusarium sp.
Las
morfoespecies de Aspergillus sp. mostraron diferencias
biológicamente manifiestas en el desarrollo de
los organismos enfrentados, demostrando la presencia
de actividad antagónica efectiva contra las diferentes
morfoespecies de Fusarium sp.
Se
presentó actividad antagónica en los diferentes
tratamientos con los hongos aislados del follaje de
heliconias, indicando que estos no solo están
ejerciendo una actividad patógena en los cultivos,
sino que también están contrarrestando,
de alguna forma, la severidad del ataque de otros fitopatógenos
más agresivos.
Se
destaca que los cultivares de heliconias presentan una
gran cantidad de microorganismos asociados, algunos
de los cuales están ejerciendo un papel antagónico
contra patógenos naturales de estas plantas.
El estudio realizado por Martínez (2008) encontró
que el cultivo, aunque tenía una abundancia de
ciertos organismos causales de enfermedad, no se encontraba
totalmente abatido. Las pruebas de antagonismo realizadas
con hongos aislados del follaje parecen indicar que
existen especies capaces de controlar las diferentes
morfoespecies de Fusarium sp., mostrando una mayor eficiencia
de las dos morfoespecies de Trichoderma sp.
5.
REFERENCIAS BIBLIOGRÁFICAS
Agrios, G. N. (2005). Fitopatología. Segunda
edición. México. Editorial Limusa, 838p.
Armstrong,
G. M. and Armstrong, J. K. (1981). Formae speciales
and races of Fusarium oxysporum causing wilt diseases.
Nelson, P.R., Toussoun, T. A. y Cook, R.J Ediciones.
Fusarium: Diseases, Biology and Taxonomy Pennsylvania
State University press, 391-399p.
Barnett,
H. and Hunter, B. (1972). Illustrated genera of imperfect
fungi. Tercera Edición Estados Unidos. Burgess
Publish Company, 225p.
Benítez,
T., Rincón, A. M. and Codón, A. (2004).
Biocontrol mechanisms of Trichoderma straits. International
microbiology, 7: 249-260.
Betancourt,
J. y Krees, W. (1993). Distribución natural
de las heliconias de Colombia. Memorias del primer
seminario nacional de heliconias y plantas afines.
Manizales, 50p.
Borrero,
C. y Silva. H. (2005). Efectos de Trichoderma (in
vitro) en los microorganismos no patógenos
descomponedores de la materia orgánica de un
suelo oxisol clase IV del piedemonte llanero. Revista
Orinoquía, 9 (2):6-14.
Cárdenas,
A. (1999). Control biológico bajo condiciones
de invernadero de Rhizoctonia solani y Fusarium oxysporum
f. sp. Lycopersici saccardo en tomate Lycopersicon
esculetum Mill empleando pregerminación controlada
de semillas y los agentes bio-controladores Trichoderma
koningii Oudemans y Pseudomonas fluorescens Migula.
Trabajo de grado. Facultad de Ciencias. Pontificia
Universidad Javeriana. Bogotá. 53p.
Cole,
J. S. and Zyenyika, Z. (1988). Integrated control
of Rhizoctonia solani and Fusarium solani in tobacco
transplants with Trichoderma harzianum and triadimenol.
Plant Pathology, 37: 271-277
Correa,
M., y Peñuela. A. (2002). Aspectos de la biología
de un hongo del género Rhizoctonia y de su
interacción in vitro con Fusarium oxysporum
f. sp. dianthi. Acta Biológica Colombiana,
7 (1):41-52.
Cotes,
A. (1993). Study of common bean protection against
damping-off by treatment of seeds with Trichoderma
koningii Oudemans. Tesis de Doctorado. Gembloux, Facultad
de Ciencias Agronómicas. élgica, 120p.
Escalona,
F., Maciel, N. y Renaud, J. (1992). Un manchado de
las inflorescencias de heliconias. Trabajo de grado.
Escuela de Agronomía, Universidad Centro Occidental
Lisandro Alvarado. Barquisimeto, 182p.
Hammer,
O., Harper, D. A. and Ryan, P. D. (2001). Past: Paleontological
Statics software package for education and analysis.
Paleontología Electrónica, 4(1): 1-9.
Harman,
G. E., Latorre, B., Agosin, E., Martin, R.S., Riegel,
D. G., NIelsen, P. A., Tronsmo, A. and Peterson, R.
C. (1996). Biological and integrated control of Botrytis
bunch rot of grape using Trichoderma sp. Biological
Control, 7:259-266.
Hermosa,
M. R., Grondona, I., Iturriaga, E. A., Díaz-Minguez,
J. M., Castro, C., Monte, E. and Garcia-Acha, I. (2000).
Molecular characterizacion and identificación
of biocontrol isolates of Trichoderma sp. Applied
and Environmental Microbiology, 66 (5): 1890-1898.
Kress,
W., Betancur, J., Roesel, C. y Echeverry, B. (1993).
Lista preliminar de las Heliconias de Colombia y cinco
especies nuevas. Caldasia, 17(82): 183-197.
Madriz,
R., Smith, G. y Noguera, R. (1991). Principales hongos
patógenos que afectan algunas especies del
género Heliconia. Agronomía Tropical,
41(5-6): 265-274.
Martínez,
E. (2008). Caracterización y diagnóstico
de hongos fitopatógenos presentes en cultivares
de la familia Heliconaceae en el Parque Nacional de
las Heliconias Caicedonia – Valle. Tesis de
pregrado. Cali, Colombia. Universidad del Valle, Facultad
de Ciencias, 75p.
Mónaco,
C. (1997). Presencia y frecuencia de la micoflora
saprobia del filoplano de tomate y su posible uso
para el control biológico de Alternaria solani
(Ell & Mart) Jones & Grout. Tesis de Magister.
Facultad Ciencias. Agrarias y Forestales (UNLP). La
Plata, Buenos Aires, 60p.8.
Extraído de: <http://www.proexport.com.co/intelexport/aplicación/frames.asp?origenadmin=impoadmin>
consulta: 15 enero 2008.
Saldarriaga,
Y. y Pineda, F. (2001). Manual de Micología
aplicada. Editorial Universidad de Antioquia. Medellín.
Colombia, 97p.
Smith,
I. M., Dunez, J., Lelliott, R. A., Phillips, D. H.
y Archer, S. A. (1992). Manual de enfermedades de
las plantas. Segunda edición. Editorial Mundi-prensa.
Madrid. España, 671p.
Trapero,
A., Llácer, G. y López, M. M. (2000).
Los hongos fitopatógenos. Trapero, A., Bello,
A. Ediciones Patología Vegetal. Segunda edición.
Editorial Mundi-Prensa. España, 713-738
|

