|
RESUMEN
A
fin de conocer el antagonismo que se produce
entre las bacterias patógenas humanas
y los hongos, se recogieron muestras de
la rizósfera de tres humedales ubicados
en la empresa Acuavalle (Ginebra), así
como de las aguas residuales que los alimentan.
Se identificaron los hongos y las bacterias
presentes en las muestras potencialmente
patógenas y luego se puso a prueba
para identificar el antagonismo entre los
microorganismos, utilizando diferentes sustratos
para el crecimiento. Se encontró
que los hongos aislados, producen metabolitos
secundarios para inhibir el crecimiento
de las bacterias cuando se utiliza el extracto
de malta. También que mediante el
uso de agar nutritivo, morfoespecies de
los géneros Aspergillus y Penicillium
son capaces de inhibir el crecimiento de
bacterias. Al compara
índices
de diversidad de hongos, el humedal heliconia
mostró mayor riqueza de morfoespecies.
El humedal Phragmites tuvo la menor diversidad
de los humedales y el control de la riqueza
de especies menores.
PALABRAS CLAVE
Hongos antagonistas, bacterias patógenas,
rizósfera, humedales.
ABSTRACT
In order to know the antagonism that
occurs between bacteria patogenic human
and fungi, were collected rhizosphere samples
from three wetlands located in the company
Acuavalle (Geneva), as well as wastewater
that feed them. We identified fungi and
bacteria present in potentially pathogenic
samples collected and then was tested to
identify antagonism between microorganisms,
using different substrates for growth. It
was found that fungi isolated, produce secondary
metabolites to inhibit the growth of bacteria
when using malt extract. Also that by using
nutrient agar, morphospecies of the genera
Aspergillus and Penicillium are able to
inhibit the growth of bacteria. When comparing
the different rates of fungal diversity,
the heliconia wetland showed higher morphospecies.
The Phragmites ¨wetland had the lowest
diversity and control wetland the lower
species richness
KEYWORDS
Antagonistic
fungi, pathogenic bacteria, rhizosphere,
wetlands
1. INTRODUCCIÓN
Los cuerpos de agua, son afectados permanentemente
por factores antrópicos y naturales.
Dentro de los factores generados en la naturaleza,
se destacan el clima, la geología,
la geomorfología, la escorrentía,
los suelos y las características
de la cuenca que definen la hidrodinámica
de las corrientes. Entre los factores antrópicos
los más destacados son los incendios
forestales; las descargas de aguas residuales,
los vertimientos de residuos peligrosos,
los drenajes mineros, los derrames de petróleo,
las escorrentías agrícola,
pecuaria y urbana; la erosión, los
lixiviados de rellenos sanitarios y los
resultantes de las actividades recreativas
(AWWA, 1990) (citado por Castro, 2003).
Todos los aspectos anteriores afectan la
calidad y cantidad de un recurso hídrico
cada vez más escaso y contaminado,
indispensable para el sostenimiento de la
vida en el planeta, haciendo inaplazable
el planteamiento de acciones para controlarlos.
Las descargas de aguas residuales de los
asentamientos humanos, se destacan de manera
especial dentro de ese conjunto de factores,
por incrementar la contaminación
de los cuerpos de agua, afectar las diferentes
formas de vida, intensificar los riesgos
de transmisión de enfermedades por
la presencia de patógenos y limitar
los usos del recurso hídrico (Castro,
2003).
Actualmente
existe una amplia variedad de sistemas tecnológicos
para la depuración de las aguas residuales
municipales dentro de los cuales se encuentran
los humedales artificiales. Estos son sistemas
de tratamiento acuático, en los cuales
el flujo de agua se realiza en superficie
libre o a través del suelo y se usan
plantas o animales para el tratamiento de
dichas aguas (Gonzalez y Vélez, 2005).
La vegetación emergente más
utilizada comúnmente en los humedales
incluye cattails (Typha sp.), carrizos (Phragnites
communis) de uso común en los sistemas
europeos, rushes (Juncos sp.), bulrush (Scirpus
sp.) y sedges (Carex sp.) (Crites y Tchobanoglous,
2001). Es importante mencionar que las raíces
de las plantas sumergidas proporcionan sustrato
para los procesos microbiológicos
y dado que la mayoría de las macrofitas
emergentes pueden translocar oxígeno
de las hojas a las raíces, se presentan
micorrizas aerobias en la superficie de
las raíces y los rizomas. El resto
del medio sumergido tiende a carecer de
oxígeno, lo cual limita la remoción
biológica del amoníaco por
nitrificación, pero aún así,
el sistema es efectivo en la remoción
de DBO, SST, metales y algunos contaminantes
orgánicos prioritarios, dado que
su tratamiento puede ocurrir bajo condiciones
aerobias y anóxicas (US EPA a, b,
2000) (citado por González y Vélez,
2005).
Los
humedales tienen 3 funciones básicas
que los hacen atractivos para el tratamiento
de aguas residuales: la primera consiste
en fijar físicamente los contaminantes
en la superficie del suelo, la segunda,
en emplear, utilizar y transformar elementos
por intermedio de los microorganismos; y
la tercera alcanzar niveles de tratamiento
que tengan bajos consumos de mantenimiento
y energía. Además, este tipo
de tecnología permite remociones
importantes de materia orgánica,
nutrientes y microorganismos patógenos
mediante procesos bioquímicos que
se organizan en la rizósfera, debido
a la relación simbiótica existente
entre las plantas acuáticas y los
microorganismos que colonizan las raíces
de las plantas y el medio de soporte (Lara,
1999). Los microorganismos involucrados
en la remoción de patógenos
en los humedales artificiales, corresponden
a protozoarios y bacterias (Orozco,1996);
en este trabajo se identificaron y evaluaron
la acción antagónica (por
metabolitos secundarios) de hongos presentes
en la rizósfera de los humedales
ubicados en Ginebra Valle sobre bacterias
patógenas presentes en las aguas
residuales que llegan a dichos humedales
, debido a que estos microorganismos tienen
la capacidad de producir metabolitos secundarios
y comportarse como antagonistas de diferentes
especies de bacterias, deteniendo el crecimiento
de estas (Gerardi y Zimmerman, 2005). Para
evaluar la capacidad antagónica se
tomaron muestras de rizósfera de
los tres humedales y del agua residual que
entra a estos para aislar los hongos y las
bacterias, para poder observar In Vitro
si efectivamente los hongos producen metabolitos
secundarios que inhiban el crecimiento de
las bacterias patógenas presentes
en el agua residual.
2. METODOLOGÍA
Se estudió la presencia de hongos
antagónicos en la segunda carga de
tres humedales artificiales, llamados Heliconia,
Phragmites y Control debido a la vegetación
presente (el humedal Control no posee vegetación).
Los humedales están ubicados en el
municipio de Ginebra que se encuentra a
60 Km de la Ciudad de Santiago de Cali,
sus coordenadas son 30º 43 50 de latitud
norte y 76º 16 20 de longitud oeste,
presentan una altitud de 1040 msnm y su
temperatura promedio es de 23ºC.
2.1Toma de muestra
Se
tomaron tres muestras al azar de rizósfera,
en tres sitios diferentes de cada humedal.
Las muestras recolectadas, se guardaron
en bolsas plásticas selladas y se
introdujeron en neveras con hielo seco.
Este protocolo se realizó al inicio
y al final de la segunda carga. También
se tomó una muestra de agua residual
que entra a los humedales, la cual se depositó
en un material de vidrio estéril
y se refrigeró inmediatamente en
una nevera.
Obtención
de cultivos puros
Para poder realizar las pruebas de antagonismo,
se emplearon técnicas microbiológicas
para el aislamiento e identificación
de los hongos y bacterias aeróbicas
indicadoras. Las muestras de rizósfera
colectadas, fueron llevadas al laboratorio
y filtradas con un tamiz de 60 cm para lograr
mayor uniformidad. Cada muestra fue diluida
en 90 ml de agua destilada estéril
(ADE), y de manera progresiva se realizaron
siete diluciones, transfiriendo 10 g de
la muestra de rizósfera de una disolución
más concentrada a una menor (disolución
de 10-1 a 10-2) y así sucesivamente
hasta llegar a la dilución de 10-7.
Para homogenizar cada solución se
usó un agitador.
Una
vez obtenidas las diluciones, se tomó
1 ml de cada dilución (solo para
las diluciones de 10-4 en adelante) y se
sembraron en cajas petri estéril
agregando 20 ml de PDA. Los cultivos se
incubaron durante siete días, manteniendo
una temperatura constante de 27ºC.
Al
crecer los hongos, las características
macroscópicas definieron las colonias
seleccionadas para realizar el proceso de
purificación, por lo cual se volvieron
a sembrar colonias en nuevas cajas petri
con PDA, obteniendo así cultivos
puros de hongos que se identificaron y describieron
sus estructuras reproductivas (esporas y
conidios), como también la forma
de las hifas, del micelio y las características
de la colonia (color, textura).
De
las muestras de agua recolectadas, se separó
1ml de cada una y se diluyó en 99
ml de caldo lactosado estéril, incubándolo
durante 24 horas a 37ºC. Posteriormente
1ml del cultivo, se sembró por estrías
en agar MacConkey incubándolo durante
24 horas a 37ºC. A continuación,
se hicieron aislamientos de las diferentes
colonias, basándose en la morfología
microscópica de estas sobre el medio
de cultivo. Dichos aislamientos se realizaron
en agar nutritivo, se sembraron por estría
y se incubaron a 37ºC, durante 24 horas.
Una vez las bacterias crecieron, se procedió
a realizar las pruebas bioquímicas
para poder identificar las enterobacterias.
Para
asilar e identificar Pseudomonas aeruginosa,
se tomó una muestra del caldo lactosado
empleando un asa de argolla y se sembró
por estrías en una caja petri que
contenía 20 ml de agar cetrimide,
que se incubó durante 24 horas a
37ºC. Una vez se observó el
crecimiento de bacterias se verificó
si presentaba crecimiento microbiano de
color verde fosforescente, el cual fuaislado
en agar nutritivo.
Bioensayos
Se tomaron cinco muestras por cada morfoespecie
de hongos identificados para realizar los
bioensayos y se colocaron en 50 ml de extracto
de malta, dejándolos incubar durante
15 días a temperatura ambiente, posteriormente,
se introdujeron 4 aros de papel absorbente
estéril.
Por otra parte, se tomaron con un asa de
argolla cinco colonias de cada uno de los
cultivos puros de las bacterias identificadas.
Una muestra de cada colonia se transfirió
a un tubo que contenía 5 ml de caldo
nutritivo y se incubó a 35ºC
hasta que la turbidez coincidió con
la turbidez estándar (0.5 MacFarland).
Al alcanzar la turbidez estándar
las muestras se dejaron reposar durante
15 minutos y posteriormente se sumergieron
en un isótopo de algodón,
no toxico, estéril.
Cada suspensión de inóculos
fue agitada varias veces, antes de humedecer
la superficie seca de una placa de Muller-Hinton,
que se pasó tres veces por una superficie
de Agar.
Las placas se colocaron en una cámara
de flujo laminar durante un periodo de 3
a 5 minutos para que la superficie del agar
se secara. A continuación los cuatro
aros de papel absorbente estéril,
incubados en el caldo de malta se colocaron
en cada placa de bacteria patógena
identificada. Se realizaron tres repeticiones
por cada hongo y por bacteria. Durante una
semana se midió la capacidad de inhibición
producida por los hongos en cada placa y
se estimó el promedio de la misma.
Análisis
de datos
Las observaciones obtenidas fueron sometidas
a una prueba de Kolmogorov Smimov, para
verificar si tenían una distribución
normal. Como esta no se presentó
se procedió a realizar estadística
descriptiva.
Se
calculó la diversidad de los humedales,
determinando los índices de diversidad
de Simpson (Ds), la varianza para cada índice,
el primer y segundo número de Hill
(N1 y N2). Se utilizó el estadístico
t-student para identificar diferencias significativas
entre los Ds de los humedales.
3.
RESULTADOS Y DISCUSIÓN
El muestreo de los diferentes humedales
y el análisis microbiológico
de suelo a cada una de las muestras, determinó
que en humedal Heliconia hay 19
Tabla
1. Morfoespecies fúngicas encontradas
en los tres humedales.

morfoespecies, distribuidas en 12 géneros,
donde Nodulisporium es el género
que presentó una mayor cantidad de
unidades formadoras de colonias por gramo
de suelo (Tabla 1).
Los índices de biodiversidad, indican
que este humedal presenta un índice
de diversidad de Simpson (Ds) de 0.867,
ocho morfoespecies comunes y siete especies
son muy abundantes (Tabla 2).
En el humedal Phragmites se encontraron
14 morfoespecies, distribuidas en 9 géneros
y una morfoespecie no identificada. Cladosporioum
y la morfoespecie 1 son los géneros
que presentaron una mayor cantidad de unidades
formadoras de colonias por gramo de suelo
(Tabla 1). Para este humedal se obtuvo un
Ds de 0.515, dos morfoespecies comunes y
dos morfoespecies muy abundantes (Tabla
2).
En
el humedal control se observaron 6 morfoespecies,
representadas en 4 géneros, donde
los géneros con mayor cantidad de
especies corresponden a Cladosporioum y
Penicillium debido a que ambos (Tabla 1).
Los índices de diversidad para este
humedal, presentaron un Ds de 0.519, dos
morfoespecies comunes y dos morfoespecies
muy abundantes (Tabla 2).
Tabla
2. Índices de diversidad para los
tres humedales

La comparación de los Ds de cada
humedal, mostró diferencias significativas
entre ellos (Tabla 3).
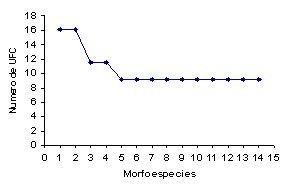
En
este sentido, el humedal Phragmites presentó
una diversidad significativamente menor,
debido a la dominancia de Cladosporioum
sp4 y la morfoespecie 1, las cuales representaron
el 98.5% de las UFC del conteo total realizado
para este humedal (2*107 UFC). Este valor
de UFC es significativamente diferente con
relación a las otras morfoespecies
del humedal, ya que las otras 12 morfoespecies
representan solamente el 1.5% del conteo
total de UFC (2.9*105 UFC), lo que influye
negativamente en la heterogeneidad del humedal.
Este
resultado sugiere que en el humedal Phragmites
existe una menor probabilidad de seleccionar
aleatoriamente dos individuos de especies
diferentes (Figura 1a), en comparación
con los humedales Control y Heliconia (Tabla
2).
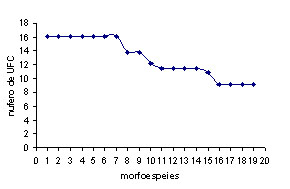
El
humedal Heliconia presentó la mayor
diversidad y riqueza de especies (19 morfoespecies),
mayor número de individuos, de especies
muy abundantes, de especies comunes y un
mayor aporte proporcional de UFC de todas
las morfoespecies con relación a
la totalidad de UFC registradas en el humedal.
(Figura 1b).
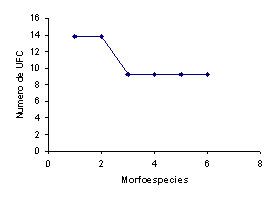
Para
el humedal control se observó una
diversidad intermedia en comparación
con los otros humedales, con dos morfoespecies
abundantes y una riqueza de seis morfoespecies
(Tabla 2 y Figura 1), quizás debido
a que presenta un aporte más uniforme
de UFC por morfoespecies con respecto al
total de UFC del humedal y en comparación
con el humedal Phragmites. A su vez, este
humedal al ser comparado con el humedal
Heliconia, presenta un menor número
de UFC y un menor número de morfoespecies,
lo que hace que posea una menor riqueza
(Figura 1c y Tabla 2).
Tabla 3. Estadístico
de prueba (t de student) para realizar comparaciones
entre los humedales.

A

B

C

Figura
1. Abundancia relativa de las morfoespecies
de los humedales:
A. Phragmites. B. Heliconia. C. Control.
El humedal control posee el menor número
de morfoespecies y de unidades formadoras
de colonias (Tabla 1), probablemente debido
a la presencia de vegetación en los
humedales Phragmites y Heliconia, la cual
puede generar un ambiente propicio para
el desarrollo de diferentes especies de
hongos. El material vegetal en descomposición,
es fuente de nutrientes, específicamente
carbono, que facilita el desarrollo de hongos
y otros microorganismos Sylvia et al., (2005).
Además, las raíces de estas
plantas proveen oxigeno, creando ambientes
aerobios que favorecen el desarrollo de
microorganismos (Rodríguez, 2002).
Igualmente, las raíces pueden estar
creando un filtro físico, reteniendo
la materia suspendida donde se pueden encontrar
los hongos (esporas, micelio o clamidosporas).
Lo anterior permite que los hongos se diseminen
fácilmente a través del agua
residual, exponiéndolos más
tiempo a condiciones propicias para que
germinen las esporas y/o se desarrolle el
micelio, imposibilitando que estos abandonen
el humedal con el efluente. El humedal Control
por carecer de vegetación, no tendría
una fuente de nutrientes y de oxígeno
diferente a la producida por el agua residual,
lo que puede estar limitando e influyendo
en la germinación de esporas de las
diferentes morfoespecies de hongos que se
encuentren en el humedal o en la longevidad
de estos. Por esta causa, al no encontrarse
las condiciones propicias como nutrientes
adecuados, concentración de oxígeno,
temperatura, y otros factores bióticos
y abióticos, las esporas no germinan
o el micelio simplemente no crece y los
hongos mueren Sylvia et al. (2005); Herrera
y Ulloa, (1998). Además, el sustrato
al encontrarse libre de raíces, presenta
movilidad y las esporas y el micelio que
se encuentran en el agua, o en la rizósfera
del humedal, se desplazan libremente, saliendo
del humedal.
El
humedal Control satisface las necesidades
eco-fisiológicas para el desarrollo
de los hongos Aspergillus, Cladosporioum
y Penicillium, a pesar de que dichos humedales
se encuentran desprovistos de vegetación.
Pero, aunque se identificaron morfoespecies
fúngicas pertenecientes a diferentes
géneros en los tres humedales, no
se puede decir que estos son los únicos
géneros que se encuentran en el humedal,
debido a que hay especies de hongos que
no son cultivables en medios artificiales
debido a que son parásitos o simbiontes
obligados Herrera y Ulloa (1998); Sylvia
et al. (2005).
Con
respecto a la prueba de antagonismo, realizada
entre los hongos y las bacterias (Escherichia
coli, Pseudomonas aeruginosa, Hafnia Alvei
y Proteus penneri), los resultados encontrados
no mostraron evidencia de inhibición
del crecimiento de las bacterias, es decir
no se observaron halos de inhibición
alrededor de los discos que tenían
los metabolitos del hongo (Figura 2) .Se
puede atribuir a que las diferentes morfoespecies
de hongos en caldo de malta, no producen
metabolitos secundarios que inhiban el crecimiento
de las bacterias utilizadas en esta prueba,
o probablemente a que estos hongos, si producen
metabolitos secundarios con poder antibiótico,
pero las bacterias nativas del agua residual
son resistentes a estos, la causa puede
ser también a que la concentración
de los metabolitos secundarios producidos
por los hongos durante los 15 días,
no es suficiente para generar inhibición
del crecimiento.
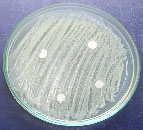
Se observa la ausencia de inhibición
en el crecimiento de las bacterias del agua
residual por parte de los metabolitos secundarios
de Aspergillus sp1:
a)
Aspergillus sp1 vs P aeruginosa. b) Aspergillus
sp1vs H. alvei. c). Aspergillus sp1 vs P.
penneri. d). Aspergillus sp1 vs E.coli.
Con
el fin de corroborar los resultados mostrados
en la figura 2, se realizó una prueba
adicional, utilizando como
 a
a 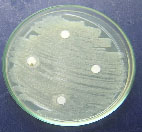 b
b 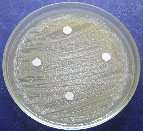 c c
 d
d
Figura
2 .Resultados del bioensayo.
hongos
antagónicos los géneros con
mayor capacidad de inhibir el crecimiento
de bacterias.
Se empleó como sustrato agar nutritivo
y se seleccionaron las morfoespecies pertenecientes
a los géneros Aspergillus y Penicillium,
que se sembraron en agar nutritivo en el
extremo de una caja petri. Se incubaron
durante siete días tres cajas petri
por bacteria (Tabla 4), y posteriormente
se inocularon las bacterias en el extremo
opuesto a donde se sembró el hongo.
Este
ensayo realizado con Aspergillus sp1 y Penicillium
sp1 produjo inhibición sobre las
bacterias P. penneri, Hafnia alvei. (Figura
3 y Tabla 4), lo que indica que el sustrato
influye sobre la producción de los
metabolitos secundarios producidos por los
hongos, debido a que estas mismas morfoespecies
fúngicas en el primer ensayo no produjeron
inhibición. Es probable que la causa
pueda atribuirse a que los medios de cultivos
utilizados (agar nutritivo y malta) están
compuestos por diferentes nutrientes, que
actúan de manera diferente en las
rutas metabólicas que utilizan los
hongos, lo que implica variación
en la producción de los metabolitos
secundarios, ya que dependiendo del tipo
de nutrientes
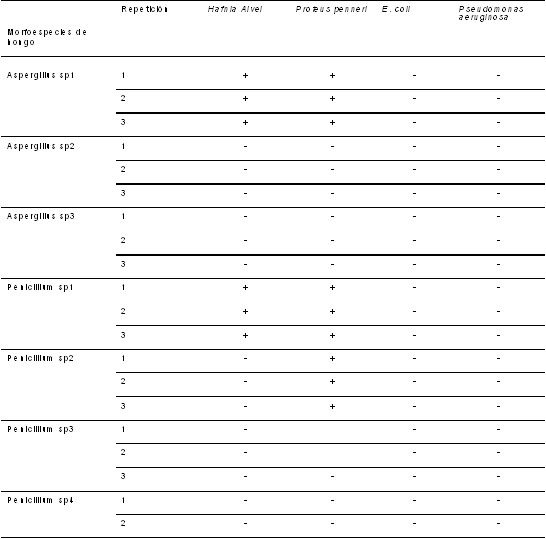
Tabla 4. Inhibición
en agar nutritivo causada por los metabolitos
secundarios de los hongos sobre las bacterias
aisladas del agua residual que entra a los
humedales.
 a
a 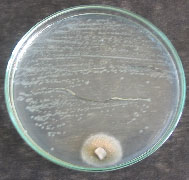 b
b 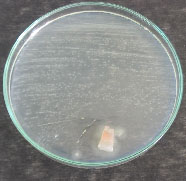 c c
Figura 3. Antagonismo
en agar nutritivo.
y
el agotamiento de estos los hongos pueden
generar diferentes metabolitos secundarios
específicos (Moore, 1998), que en
este caso serian metabolitos con capacidad
antibiótica. Por ello los resultados
obtenidos en los bioensayos realizados en
esta investigación no representan
lo que ocurre en la rizósfera de
los humedales, debido a que las condiciones
nutricionales y ecológicas de estos
ecosistemas son diferentes a las condiciones
ideales de los medios de cultivo.
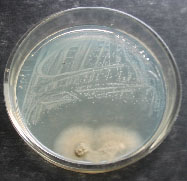
En
esta Figura 3 se observa la inhibición
producida por los hongos sobre las bacterias.
a. Aspergillus sp1 vs P. penneri. b Penicillium
sp1 vs P. penneri. c Penicillium sp2 vs
P. penneri.
4. CONCLUSIONES
Los humedales observados poseen un gran
potencial biotecnológico; allí
se encuentran géneros fúngicos
de importancia económica, como son
los géneros Aspergillus y Penicillium
por su producción de antibióticos,
el género Trichoderma y Paecelomices
los cuales son usados en el control biológico
de microorganismos e insectos.
Los
humedales permiten realizar procesos de
incremento de especies pertenecientes de
los géneros Trichoderma y Penicillium
para ser aplicarlos a otros humedales diferentes.
Se
observó que la remoción biológica
de los humedales aumenta, debido a que las
especies de estos géneros tienen
la capacidad de producir metabolitos secundarios
con propiedades antibióticas.
5.
RECOMENDACIONES
Es conveniente realizar otros bioensayos
utilizando medios de cultivo con extracto
de suelo proveniente de los humedales, debido
a que con este método se podría
simular los nutrientes de la rizósfera
de los humedales en una caja petri.
Pruebas
de antagonismo realizadas a muestras de
rizósfera directamente en los humedales
empleando el respirómetro, permitirían
observar si el crecimiento de los hongos
produce metabolitos secundarios que inhiban
el crecimiento de las bacterias aeróbicas
y anaeróbicas.
6.
REFERENCIAS BIBLIOGRÁFICAS
American Water Works Association.(1990).
Water Quality and Treatment. United States,
McGraw-Hill. 1194p.
Castro,
A. (2003). Selección de Alternativas
Sostenibles para el Tratamiento de Aguas
Residuales Municipales en Colombia: un Método
con Énfasis en los Aspectos Tecnológicos.
Tesis de maestría. Cali-Colombia.
Universidad del Valle.
Crites,
R.; y Tchobanoglous, G. (2001). Sistema
de Manejos de Aguas Residuales. Bogotá,
Mc GrawHill.1102p.
Gerardi,
M. H. y Zimmerman, M. C. ( 2005). Wastewater
Pathogens. New Jersey, John Wiley &
Sons, Inc. 179p.
González,
C. y Vélez, C. (2005). Evaluación
del Funcionamiento de un Humedal Artificial
de Flujo Sub-superficial Para el Tratamiento
de los Lixiviados del Vertedero de Navarro
de Santiago de Cali. Tesis de pregrado Universidad
del Valle, Cali, Colombia.
Herrera,
T. y Ulloa, M. (1998). EL REINO DE LOS HONGOS.
2a ed. México, Fondo de cultura económica,
S.A. 550p.
Lara,
J. (1999). Depuración de Aguas Residuales
Municipales con Humedales Artificiales.
Universidad Politécnica de Cataluña,
Barcelona, España.
Moore,
D. (1998). Fungal Morphogenesis. United
States, Cambridge University Press. 463p
Orozco,
D. (1996). Fate of pathogens in Nakiwbo
Swamp. Kampala-Uganda, IHE DECFT. 92p.
Rodríguez,
G. (2002). Principales características
y diagnóstico de los grupos patógenos
de Escherichia coli. Salud Pública
de México. 44(5): 464-475
Sylvia,
D. Fuhrmann; J.J.; Hartel, P.G.; y Zuberer,
D.A.; (2005). Principles and Applications
of Soil Microbiology. 2a ed. New Jersey,
Pearson Prentice Hall. 640p.
US
EPA .(2000a). Humedales de flujo libre superficial.
Washington DC, EPA.10p
US
EPA . (2000b). Humedales de flujo subsuperficial.
Washington DC. EPA. 13p.
|
